Diapositiva número: 1

Hola, buenas tardes. Lo primero, por supuesto, agradecer al comité organizador que me invitara a venir a Cádiz. La verdad es que es un placer, me encanta Cádiz y, aunque que me ha costado bastante esta vez llegar, estoy encantada de estar aquí.
Supongo que vamos a estar un poco en "petit comité" porque ya sabemos que mucha gente está en Praga y cuando me propusieron preparar la charla, pues le di vueltas a cómo prepararla. No sabía muy bien a qué tipo de público me iba a enfrentar, con lo cual he hecho una mezcla que espero que os resulte interesante. Más o menos hemos decidido que al final van a ir las preguntas, pero luego si alguien tiene ganas de interrumpir o comentar algo, pues lo hacemos sobre la marcha.
Diapositiva número: 2
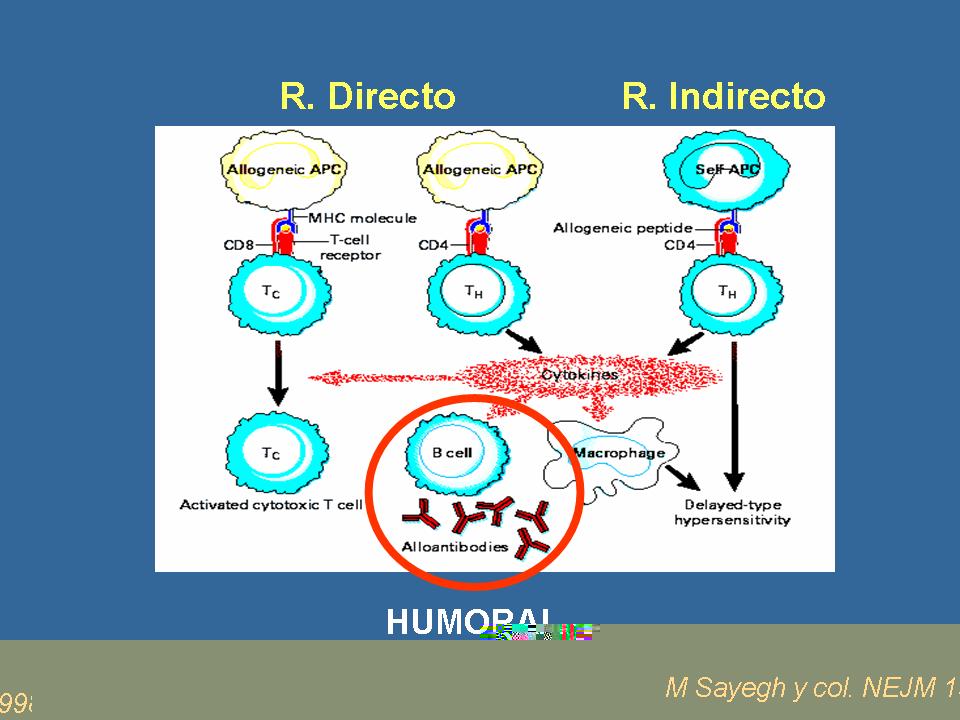
Como el título de la charla es bastante amplio, a lo que hace referencia es en concreto a la participación de estos anticuerpos en la respuesta inmune del receptor frente al injerto. Lo primero y lógico, que probablemente todos sabéis, es que la respuesta mediada por anticuerpos, los anticuerpos en la respuesta inmune no se presentan o no actúan solos, no proceden de una celda aislada, sino que es una celda de un contexto que viene estimulada por los linfocitos T, por las citoquinas. Es decir, es bastante complejo, pero vamos a intentar centrarnos en lo que es la clínica, lo que son los conceptos claros hoy en día.
Diapositiva número: 3

Como os decía, he intentado hace una especia de potpurrí de alguna manera, porque sé que hay gente que puede haber oído una charla sobre el rechazo agudo humoral previamente, entonces he intentado incluir alguna otra cosa, alguna novedad, hablar algo del rechazo crónico para que fuera un poco más enriquecedor para los que hubieran oído algo. Lógicamente, no hay mucho tiempo, con lo cual pasaré sobre muchas cosas por encima.
Lo he querido dividir en algo así como teoría y práctica, porque cuando a veces hablo con vosotros en los congresos, pues los conceptos yo creo que todos los tenemos bastante claros y el problema es cuando nos enfrentamos a los pacientes. No voy a resolver las grandes dudas, pero a lo mejor un poco, con el planteamiento que hemos hecho con algunos pacientes que hemos tenido nosotros, pues puede ayudar un poco a la experiencia clínica. Y nada, y una par de "diapos" finales con algunas reflexiones.
Diapositiva número: 4

Desde el punto de vista de la teoría
Diapositiva número: 5

no he podido evitarlo aunque debería haberlo hecho porque tengo poco tiempo
Diapositiva número: 6

evitar hablar del rechazo hiperagudo porque yo creo que es el inicio de esta historia y teniendo claro el rechazo hiperagudo, se entiende muy bien el rechazo agudo humoral y todos sabemos que es un rechazo que se conoce desde el principio de la experiencia clínica en trasplante, cuando los clínicos empezaron a ver que perdían injertos que estaban infiltrados por polimorfonucleares, como se ve en esta foto del año me parece que del año 66 o 67. Esta experiencia la recogieron de forma amplia Patel y Terasaki. Terasaki era un inmunólogo que ha vivido toda la historia del trasplante publicando grandes artículos y ha sido la cabeza, de manera que en el 69 junto con Patel, publicó este papel que hablaba de que los pacientes que tenían anticuerpos frente a los donantes perdían sus injertos con mucha más frecuencia que aquellos que no tenían anticuerpos. Esto lo reflejan en esta publicación que ha sido un hito en la historia del trasplante y que ha marcado la regla de oro, o hasta hace poco regla de oro, de no trasplantar si no teníamos una prueba cruzada negativa. Ya sabemos que todo esto está cambiando gracias a que conocemos mejor este tipo de rechazos.
Diapositiva número: 7
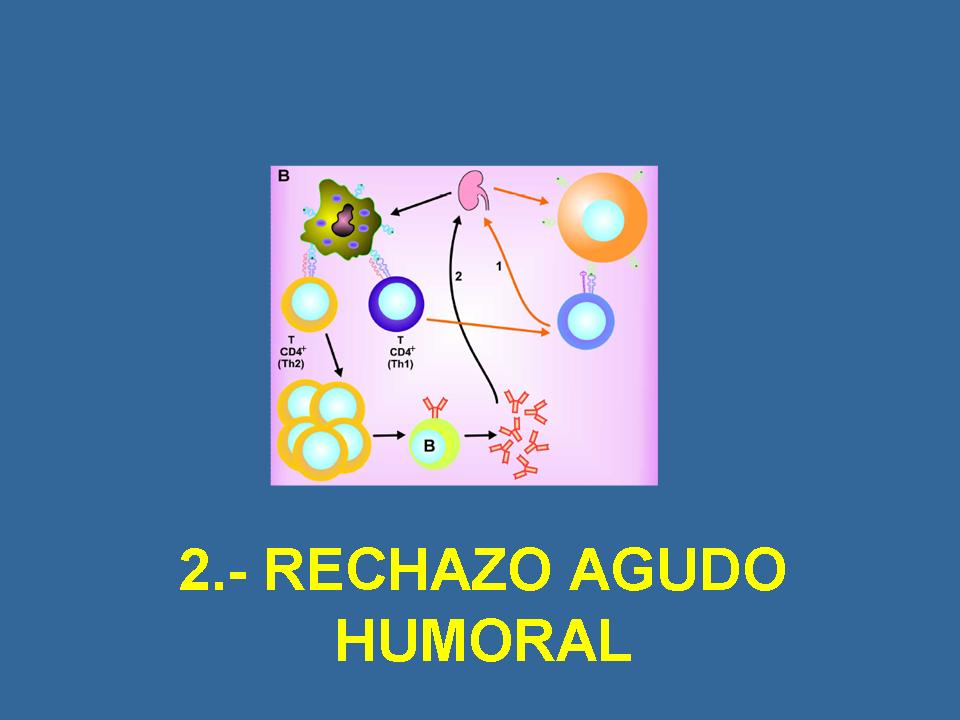
Diapositiva número: 8
Y esto llevó muy poco después al conocimiento del rechazo agudo humoral. Ya en el año 70 un investigador suizo que trabajaba en Boston, habló de que no sólo en los pacientes que tenían anticuerpos previos al trasplante perdían el injerto de forma muy rápida después del trasplante, sino que aquellos que no los tenían y los desarrollaban en las primeras semanas después del trasplante, también los perdían con mucha más frecuencia que aquellos que se trasplantaban con cross-match negativo y seguían manteniendo ese cross-match negativo después del trasplante. Es decir, que el grupo de Boston ya entonces habló de que la aparición de nuevos anticuerpos donante-específicos indicaba un mal pronóstico para el injerto. Y sin embargo, de forma sorprendente, hasta los años 90 no se recuperó esta teoría. Lógicamente, los inmunólogos y los clínicos siguieron hablando del mal pronóstico que implicaban los anticuerpos, pero no se emplearon las herramientas adecuadas para definir -como se ha hecho a lo largo de la última década y media- el rechazo agudo humoral.
Fue a principio de los años 90 cuando otro grande del trasplante, que es Halloran, en Canadá, junto con su grupo se dedicó a estudiar una serie de pacientes que tienen unos rechazos muy, muy severos, que perdían los injertos y que tenían una alta prevalencia de lesiones vasculares en esos injertos perdidos y neutrófilos en los capilares peritubulares y pensó en aquella entidad del rechazo hiperagudo y realizando cross-match post-trasplante trasplante con las células del donante, observó que estos pacientes tenían anticuerpos frente a las células del donante. Él dijo que anticuerpos ante los antígenos HLA de clase I.
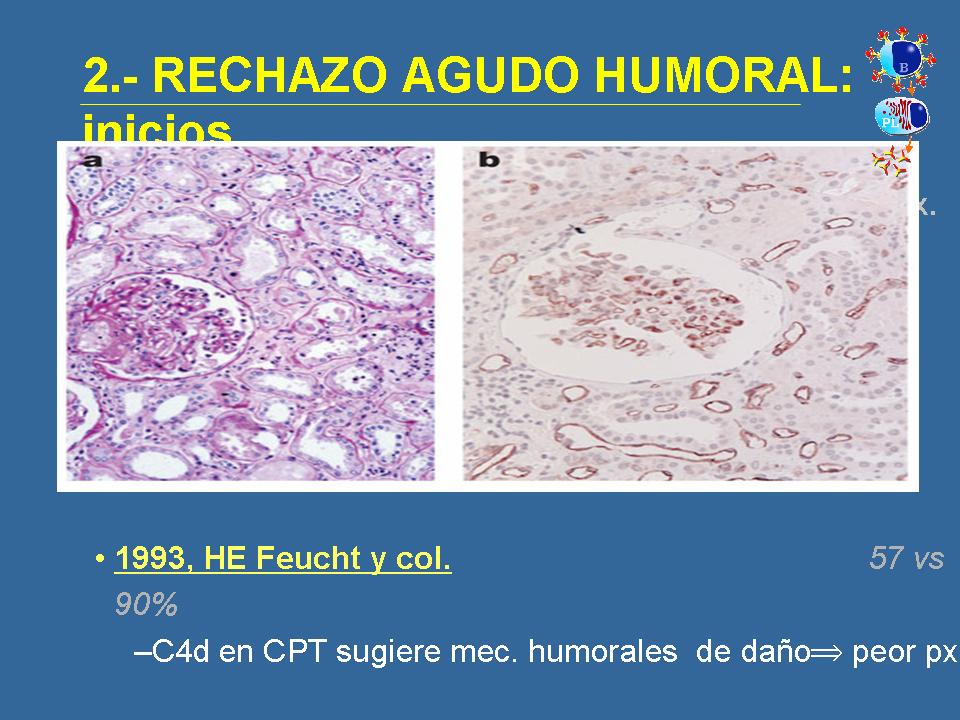
Y de forma paralela, en Alemania, Feucht investigaba con el C4d, que es una fracción derivaba de la alteración de la vía clásica del complemento, y observaba que la presencia de esta fracción en los capilares peritubulares de biopsias de injertos, implicaba un mal pronóstico para esos injertos, que esos injertos se perdían o tenían pero función.
Estos estudios los hizo con técnica inmunohistoquímica -luego comentaré algo con respecto a las técnicas que creo que es algo que también suele interesar
Diapositiva número: 9

y que faltaba algún grupo que conectara algo que era obvio y que ya decía Feucht, que el C4d probablemente se debía a que había una activación humoral mediada por anticuerpos.
Diapositiva número: 10
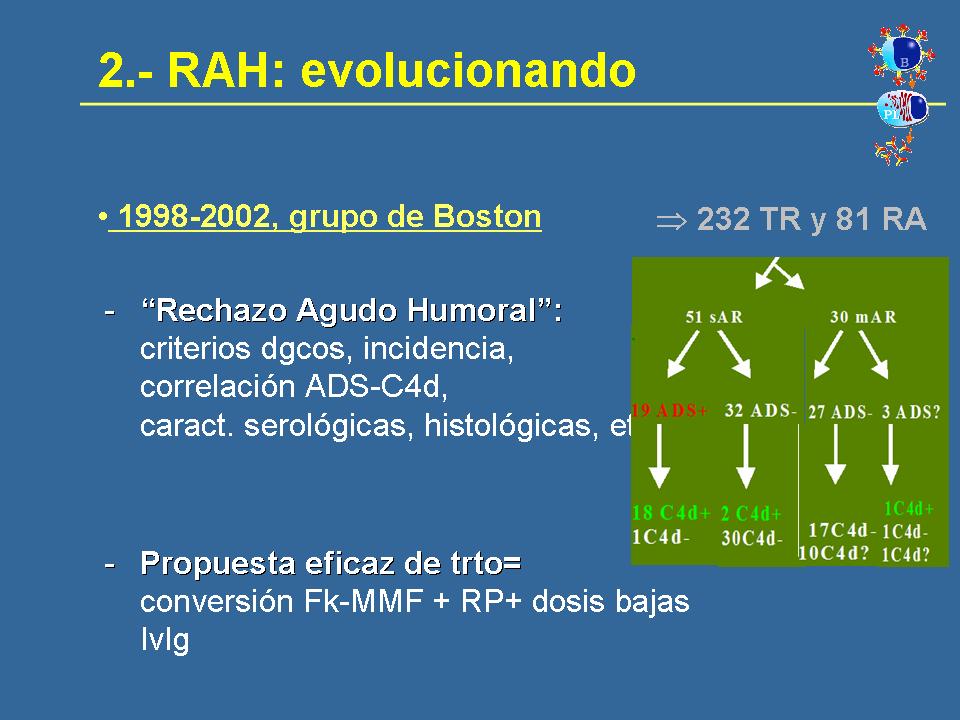
Había que ligar el C4d con los anticuerpos y esto, afortunadamente, sucedió cuando yo estaba en Boston haciendo una rotación de residente. O sea que fue una casualidad y por ellos empecé a dedicarme a trabajar en este tema.
Entre el 98 y el 2002, el grupo de Boston publicó varios artículos dedicados al rechazo agudo humoral, partiendo fundamentalmente -aunque hubo estudios paralelos- del estudio minucioso de 81 pacientes que sufrieron rechazo agudo durante los 3 primeros meses post-trasplante de una serie de 232 receptores de trasplante consecutivos. En concreto se estudiaron con más detalle los rechazos corticorresistentes y dentro de ellos se encontró que 19 pacientes tenían rechazo corticorresistente con anticuerpos anti-HLA del donante, que aparecían de nuevo post-trasplante y que la mayor parte de ellos, 18 de 19, tenían depósitos de C4d en los capilares peritubulares de esas biopsias. De manera que se sugirieron unos criterios de diagnóstico para esta patología, se habló de la incidencia que encontrábamos en nuestro contexto. Sobre todo se encontró una correlación muy buena entre los anticuerpos donante-específicos y el C4d, incluyendo anticuerpos donante-específicos también frente a antígenos HLA de clase II, completando un poco la información de Halloran previa. Se habló de las características serológicas e histológicas, y también de ese centro partió una propuesta de tratamiento diferenciado de esta entidad, puesto que la mayor parte de los pacientes que sufrían este tipo de rechazo, que lo hemos visto en nuestra experiencia corticorresistente, la de Halloran no sólo era corticorresistente, sino también resistente al tratamiento con anticuerpos antilinfocitarios, con lo cual, se propuso la conversión del Tacrolimus en micofelonato en una época en la que esto no era una norma tan extendida, y la realización de recambios plasmáticos y la utilización de dosis bajas de gammaglobulina policlonal.
Diapositiva número: 11

Este estudio y otros muchos, finalmente dieron lugar a una modificación importante, o la modificación más importante que sufrió la clasificación de la Banff en la reunión del año 2003, y fue desarrollar la categoría II incluyendo una definición clara del rechazo agudo humoral mediado anticuerpos al rechazo humoral. Se ha hablado de que tienen que estar presentes cuatro criterios: la evidencia clínica de disfunción renal, la evidencia serológica de anticuerpos anti-HLA u otros anticuerpos antiendotelios donante-específicos como pueden ser los ABO. La verdad es que en la charla me voy a referir en general a los HLA porque dentro del Congreso hay una charla, si no me confundo del Dr. Alex Gutiérrez, sobre el trasplante ABO incompatible a raíz de los trasplantes ABO incompatibles que se realizaron en el Clínico, y no había incluido los MICA porque yo creo que las evidencias que hay con respecto al papel de los anticuerpos anti-MICA son menores y es un poco más confuso, y ayer me di cuenta que en el Journal del jueves publicaban un artículo muy interesante sobre el tema de los MICA y me dije "ya no ...". De manera que bueno, esa es una de las cosas que están candentes y que, probablemente, dará para charlas en el futuro. También, lógicamente, la evidencia inmunopatológica de acción de los anticuerpos junto con el C4d, y Banff incluyó también el criterio de "evidencia morfológica de lesión aguda en el tejido renal".
Diapositiva número: 12
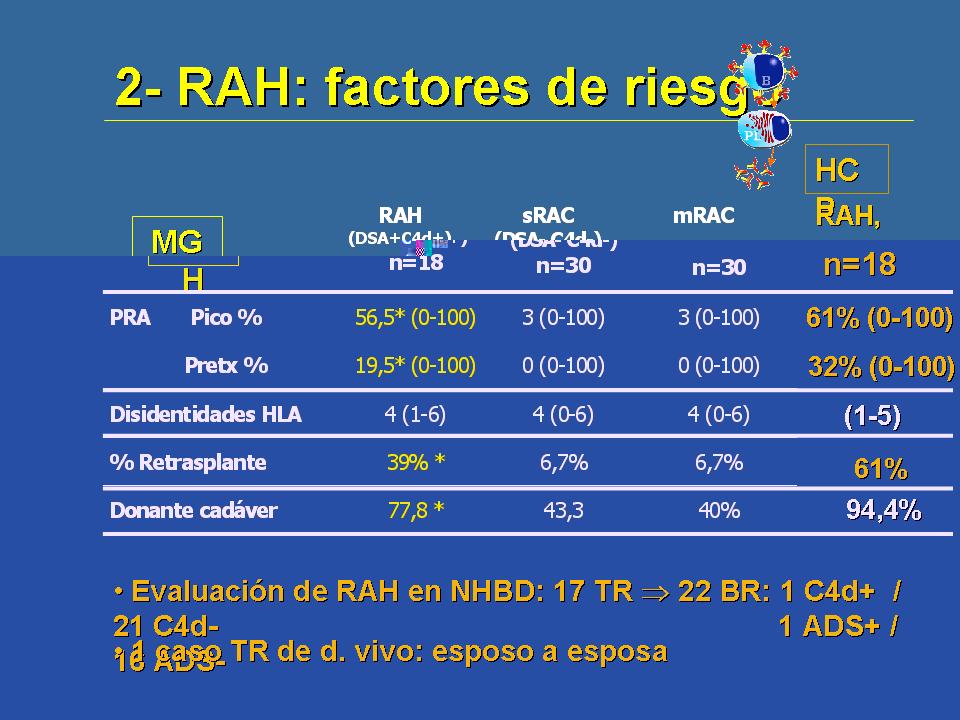
En cuanto a los factores de riesgo son unos factores de riesgo un poco clásicos de rechazo que se han confirmado de forma nuclear en el rechazo agudo humoral. Y es que en general los pacientes que tiene rechazo agudo humoral, que son estos de aquí o procedentes de la serie de Boston, o de estos procedentes de la serie del Hospital Clínico de Barcelona, en comparación con pacientes que han sufrido rechazo corticorresistente o rechazo corticosensible, pues tienen una sensibilización pretrasplante claramente superior, con mucha más frecuencia reciben un retrasplante, son pacientes retrasplantados, y parecía que en algunas series se sugería que el hecho de recibir un injerto de donante cada vez podía ser un factor de riesgo para esta patología.
Nosotros, en el Hospital Clínica de Barcelona realizamos una revisión de lo que probablemente es el modelo clínico muy bueno en isquemia, que es el injerto procedente del donante en asistolia, y estudiando 22 biopsias de 17 receptores de trasplantes de donantes en asistolia, observamos que sólo había depósitos de C4d en una de la biopsias, en concreto en una paciente retrasplantada y por eso sensibilizada, que desarrolló anticuerpos anti-HLA contra el donante. Es decir, sólo encontramos el C4d en un caso de humoral y la isquemia per se no produce o no favorece la presencia de C4d.
También hemos vivido algún caso, varios casos de humoral en trasplante de vivo y en concreto he querido incluir este aquí porque ya creo que bueno, para los grupos que hagan trasplante de vivo siempre es muy interesante tener en cuenta el caso este de esposo a esposa. Esta paciente era una paciente que recibió un primer trasplante renal, que no estaba sensibilizada ni por transfusiones, era una paciente joven que se trasplantó de su marido, del cual había tenido varios hijos lógicamente. Entre comillas, "había visto" los antígenos de su marido con motivo de los embarazos y, probablemente, aunque no fuimos capaces de detectarlo con las pruebas que hicimos pretrasplante, pues se pusieron de manifiesto en el post-trasplante. Y esto es muy importante tenerlo en cuenta en cualquier tipo de receptor, porque cuando tenemos un receptor y un donante vivo, parece que la responsabilidad es incluso mayor.
Diapositiva número: 13

Y en cuanto al tratamiento, pues se habla de todas estas cosas. Nosotros siempre hemos comentado que había un poco tres pilares básicos para el tratamiento. Un pilar era utilizar técnicas que permitieran eliminar anticuerpos, tanto los recambios como inmunoabsorción o la gammaglobulina policlonal que los bloquea y los retira de la circulación. No hay estudios que hayan comparado adecuadamente estas técnicas. Hay sólo un estudio interesante con gammaglobulina policlonal realizado con motivo de la desensibilización de pacientes antes del trasplante que demostró que la gammaglobulina es capaz de reducir la tasa de anticuerpos antes del trasplante. Pero no hay estudios comparativos y, desde luego, no los hay en el rechazo agudo humoral.
Es segundo pilar que sería evitar la síntesis de nuevos anticuerpos, aquí evidentemente hay que hablar de los inmunosupresores tradicionales y lo que proponían mis compañeros en Boston, aquello de la conversión de Tacrolimus a micofelonato, pues resulta que en muchas ocasiones hoy en día el paciente que hace un rechazo humoral ya está recibiendo ese tipo de tratamiento. Con lo cual resulta un poco obvio, pero sí que es verdad que parece que es la combinación que más sólidamente puede reducir los anticuerpos. Había una gran esperanza con los inhibidores de TOR, con la Rapa, con Everolimus, puesto que in vitro parece tener una capacidad de medición de producción de anticuerpos mucho más potente y sin embargo, en las experiencias en vivo no lo han visto mucho. Hay alguna publicación reciente con Everolimus que dice que el Everolimus es capaz de prevenir el rechazo en ratas no sensibilizadas, pero en las ratas sensibilizadas no lo previene. Los anticuerpos TOR, que luego comentaré un poquitillo, el Rituximab y luego, bueno, cosas como la ciclofoxamida, la esplenectomía que se ha utilizado como preparación para trasplantar el incompatible con cross-match positivo -sobre todo los japoneses tienen mucha experiencia en eso-, la timoglobulina que comentaré algo de ella y luego, lógicamente, tenemos que tener en cuenta las medidas habituales para el control de la respuesta inmune de forma global.
Esta publicación me ha parecido muy interesante, que es el grupo este de Zachary y está publicada en el año 2005, que intentaba buscar factores de riesgo que favorecieran la persistencia de los anticuerpos donante-específicos después de un tratamiento de sensibilización o de un tratamiento de rechazo agudo humoral. Y ellos encontraron que algunos antígenos, pues no sé si son más antiinmunogénicos, o por los menos los anticuerpos ante esos antígenos son más difíciles de eliminar; incluían el BRE51, 52 y 53, una serie de antígenos de clase II.
Y otra que me parecía muy interesante es que lo que ellos comentan, es que el uso de anticuerpos antilinfocitarios, es decir, la timoglobulina tendría un factor de riesgo que favorecería la persistencia de estos anticuerpos donante-específicos. Lógicamente esto es muy controvertido, porque hay grupos de están publicando que con timoglobulina son capaces de resolver el rechazo agudo humoral y que, lógicamente, la timoglobulina no incluye sólo anticuerpos antilinfocitos T, sino también frente a linfocitos B aunque estos en menor cuantía.
Diapositiva número: 14
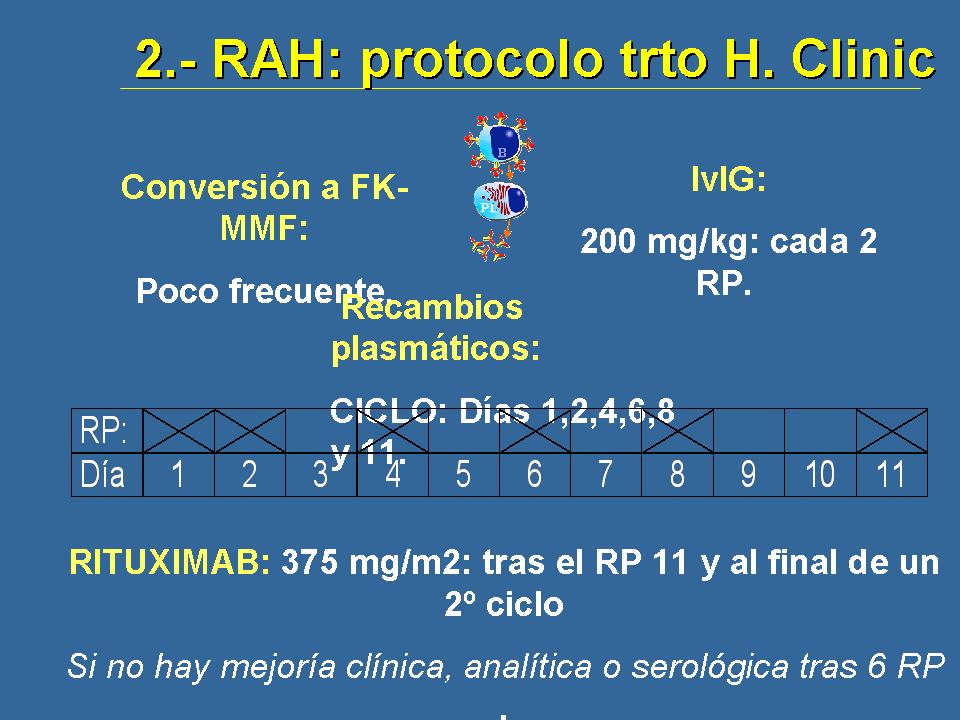
Nosotros consensuamos este protocolo en el Hospital Clínico después de los primeros casos, partiendo de la experiencia de Boston y con los casos que vivimos allí. La conversión a micofelonato, que como he dicho es poco frecuente porque la mayor parte de nuestros pacientes son pacientes de riesgo que ya los recibían, los recambios plasmáticos con este esquema, incluía el ciclo de esos recambios plasmáticos pues así alternados, según esos días ahí marcados, complementado con dosis bajas de gammaglobulina policlonal, de manera que podamos evitar el rebote en la síntesis de anticuerpos y también intentar prevenir las complicaciones infecciosas. Y cuando toda esa combinación no me resultaba, si no teníamos una mejoría clínica, analítica, serológica o histológica, lo que proponíamos era antes de repetir el segundo ciclo de recambios plasmáticos, administrar una dosis de Rituximab, si bien en principio la dosificación que utilizan los hematólogos -porque no tenemos no mayor ni menor evidencia con respecto a eso- y una segunda dosis al acabar el segundo ciclo de recambios plasmáticos. Hubo algunos casos en los que vamos a utilizar 4 dosis, pero al final lo que hicimos fue dejarlo en 2 dosis porque no parecía que añadiésemos mucho más.
Diapositiva número: 15
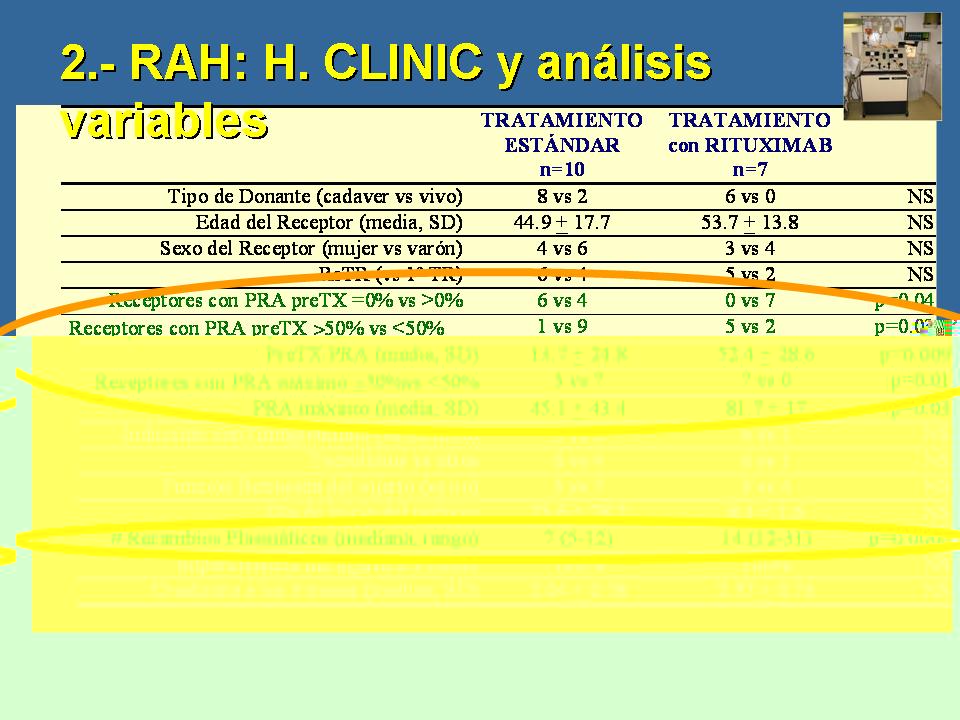
Intentamos hace dos años evaluar qué diferenciaba a los pacientes que habían respondido a los recambios plasmáticos de aquellos pacientes a los que habíamos tenido que suministrar Rituximab para resolver el rechazo humoral. Nuestra serie, la que hemos llevado a los congresos, es de 18 pacientes, eliminamos uno que no responde al tratamiento estándar -era una época en que no utilizábamos Rituximab- e intentamos hacer una comparación entre los demás. Encontramos lógicamente, que los diferenciaba los recambios plasmáticos que habían recibido. Lógicamente, los resistentes habían recibido muchos más recambios plasmáticos, pero eso no nos valía de nada porque lo sabíamos a posteriori. Y lo que sí que nos servía, eran estos datos: los pacientes que necesitaban tratamiento con Rituximab tenían una sensibilización pretrasplante, tanto pico como histórica mucho mayor
Diapositiva número: 16
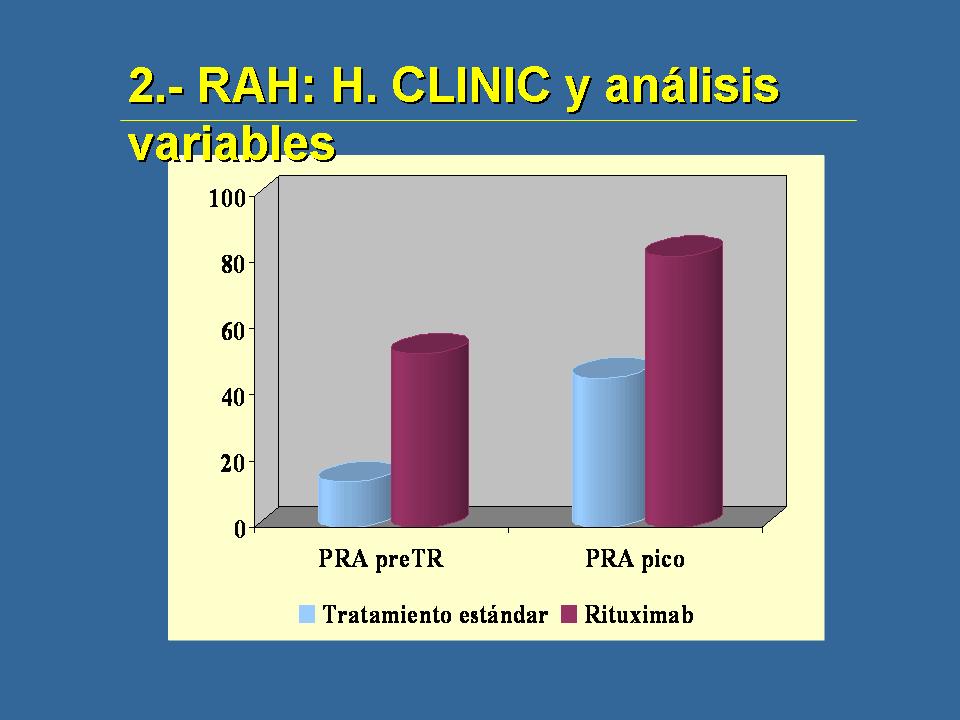
como se ve aquí. Los PRAs tanto pretrasplante como pico, son mayor en la serie de pacientes que necesitaban Rituximab y sugerimos que tal vez algunos pacientes con PRAs por encima del 50% en el momento pretrasplante, pues se beneficiarían de una inducción con Rituximab. Pero es algo que es independiente, que probablemente los americanos están haciendo pero nosotros no, porque yo, también sería imposible montar, poner esto en marcha para que pudiéramos averiguar si realmente tiene sentido hacerlo.
Diapositiva número: 17

Y con respecto al humoral crónico, que tal vez hemos hablado menos y a lo mejor es más interesante
Diapositiva número: 18

Pues la verdad es que la primera publicación de interés surge también en Boston y surgió de forma paralela a los estudios que se estaban haciendo en rechazo agudo humoral, lógicamente. Al mismo tiempo que se estudiaba el rechazo agudo, Mauiyyedi que es la autora de este artículo, hizo una revisión interesantísima de una serie de 38 biopsias o nefrectomías etiquetadas como rechazo crónico inmunológico basándose en parámetros histológicos clásicos como la glomerulopatía crónica al trasplante o la arteriopatía típica del rechazo, y comparó la presencia del C4d con biopsias con otros diagnósticos: algunas con diagnósticos de toxicidad por ciclosporina, algunos riñones negativos, algunos recibidos de glomerulares. Y encontró que de esas 38 biopsias, 23 tenían depósitos difusos de C4d en capilares peritubulares. Había sueros o se pudieron obtener sueros de hasta 17 de esos 23 pacientes y 15 de ellos tenía anticuerpos donante-específicos. Sin embargo, en el otro grupo que supuestamente no tenía un rechazo inmunológicamente mediado sólo apareció un caso de C4d de 46 y de sólo 8 pacientes con sueros, pues en ninguno se detectaron anticuerpos. Era, yo creo, la publicación interesante preliminar sobre el rechazo humoral crómico.
Diapositiva número: 19

El grupo de Viena de Regele, hizo un estudio también muy interesante, pero el procedimiento fue el contrario. Partió de 213 biopsias de injertos, biopsiados más allá de 12 meses después del trasplante, e hizo una punción a todas ellas de C4d con inmunohistoquímica. Encontró C4d en hasta 73 biopsias y lo que buscó es con qué se correlacionaba esto, lo contrario de lo que había hecho Mauiyyedi en Boston. Y los hallazgos, muy parecido lógicamente, que el C4d se correlacionaba con la presencia de la glomerulopatía crónica del trasplante en ese biopsia o en biopsias futuras, a veces predecía la aparición de la glomerulopatía, la laminación de la membrana basal en los capilares peritubulares y la presencia de células inflamatorias mononucleares también en capilares peritubulares. No encontraba que este C4d se asociara al hecho de recibir un retrasplante o de haber tenido un rechazo, aunque bueno, esto tal vez habría que re-evaluarlo hoy en día.
Diapositiva número: 20

Y desde el punto de vista de los anticuerpos, en vez de partiendo del marcador C4d, partiendo del marcador anticuerpos, pues también se han hecho trabajos muy interesantes. Este trabajo de colaboradores, que seguro que los inmunólogos lo conocen muy bien, publicado en el año 2002, es un paper en el que también está metido Terasaki, que está metido en casi todo lo que hay en anticuerpos hoy en día, pues hacen un estudio de 139 pacientes, a 108 de ellos no tienen anticuerpos aparentemente en el estudio pretrasplante, y observan que aquellos que desarrollan anticuerpos post-trasplante inespecíficos, no anticuerpos frente al donante, sino que pasan de tener PRAs de 0 a tener PRAs X, supongo que más de. -ahora mismo no sabría decir- 15%, pues esos, con más frecuencia sufren pérdida del injerto que aquellos que no desarrollan los anticuerpos, y la diferencia es claramente significativa. Y además encuentran que estos pacientes desarrollan entre 6 meses y 8 años antes de perder el injerto; es un período de tiempo bastante amplio.
Diapositiva número: 21

Terasaki vuelve a la carga con estas grandes series, utilizando los sueros de los pacientes que estamos utilizando todos en el mundo, estamos todos participando con nuestros datos en estas grandes series, y publica en el 2005 que 2.231 trasplantes, hace el estudio de anticuerpos por citotoxicidad más allá de 6 meses post-trasplante y encuentra que los 478 que hacen anticuerpos también de forma inespecífica post-trasplante, pues tienen a los dos años un 15% de pérdidas del injerto frente a sólo un 7% en los 1.450 pacientes sin anticuerpos y que eso se asocia a una peor función de injerto.
Y otras dos experiencias interesantes también de investigadores que estuvieron en Boston son estas dos. Primero hablo de la de abajo, de Francesca Caradarelli, que lo que hizo fue revisar 249 receptores de trasplante y medir los anticuerpos más de 6 meses post-trasplante. Encontró que un 11% de ellos desarrollaron anticuerpos post-trasplante y de ellos sólo un 4,5% era anticuerpos donante-específicos. De ellos, de los que tenían biopsias, el 66% presentaba depósitos de C4d en los capilares peritubulares y eso lo relacionaron con todas estas variables. Y una pequeña serie de estos pacientes de Boston, 4 receptores de trasplante renal con anticuerpos donante-específicos y con C4d en la biopsia, 3 con anticuerpos anti-HLA de clase II, que parece que es lo que podría relacionarse más con el rechazo humoral crónico, los anticuerpos frente a clase II y, probablemente, los anticuerpos frente a clase I son más prevalentes en el rechazo agudo humoral, pues lo que hicieron fue, en pacientes antiguos, tener ______ y tuvieron la oportunidad de convertir el Tacrolimus en micofelanato y observaron que dos de ellos perdían estos anticuerpos donante-específicos. Lo que no está muy claro, que de una serie de 4 perdiendo 2, pues hasta qué punto eso puede influir en la función de estos injertos.
Es una serie muy limitada, pero que todo el mundo que publica hace referencia a ella y dice que el tacrofelanato hace desaparecer los anticuerpos.
Diapositiva número: 22

Y esto, igual que pasó con el rechazo agudo humoral, motivó que la última Banff del año 2005 y que ha salido publicada hace unos meses en el American Journal of Trasplantation, pues fijase una definición bien clara del rechazo humoral crónico, unas características morfológicas de las que hemos hablado, glomerulopatía del trasplante, laminación de la membrana basal capilar y otra serie de lesiones a lo mejor más inespecíficas combinadas con la presencia de depósitos difusos de C4d de los capilares peritubulares, la presencia de anticuerpos donante-específicos -bueno, esto es una foto de una glomerulopatía crónica del trasplante- y la laminación de los capilares peritubulares, que lógicamente esto es una foto del óptico, que me ha pasado el patólogo del Clínico, con el que sigo trabajando, pero para ver la laminación de los capilares peritubulares necesitaríamos el electrónico. Pero ¿quién hace electrónico en trasplante? Pues muy poca gente y quien lo hace es con motivos de investigación, no con orientación clínica.
Y lo que decía que resulta muy interesante, es que no se habla del cuadro crónico cuando se propone esta definición en Banff cuando en el agudo humoral sí que se hablaba de que tenía que haber una disfunción renal.
Diapositiva número: 23

. Y probablemente, porque la gente está aceptando esta hipótesis de Colvin, que es uno de los patólogos con más peso de Estados Unidos, que dice que probablemente el rechazo humoral crónico ha evolucionado de esta manera: primero aparecen los anticuerpos donante-específicos, como decía allí entre 6 meses y 8 años antes del trasplante; luego puede aparecer el C4d, que muchas veces ya hemos dicho que es anterior a la aparición de la glomerulopatía crónica del trasplante, es decir que después va aceptación histológica y después va la disfunción clínica. Entonces, lo que no sabemos es en qué punto nos encontramos cuando cogemos el paciente. La mayor parte de las veces, probablemente aquí no, porque sí lo biopsiamos porque tiene proteinuria o porque tiene deterioro de la función renal.
Diapositiva número: 24
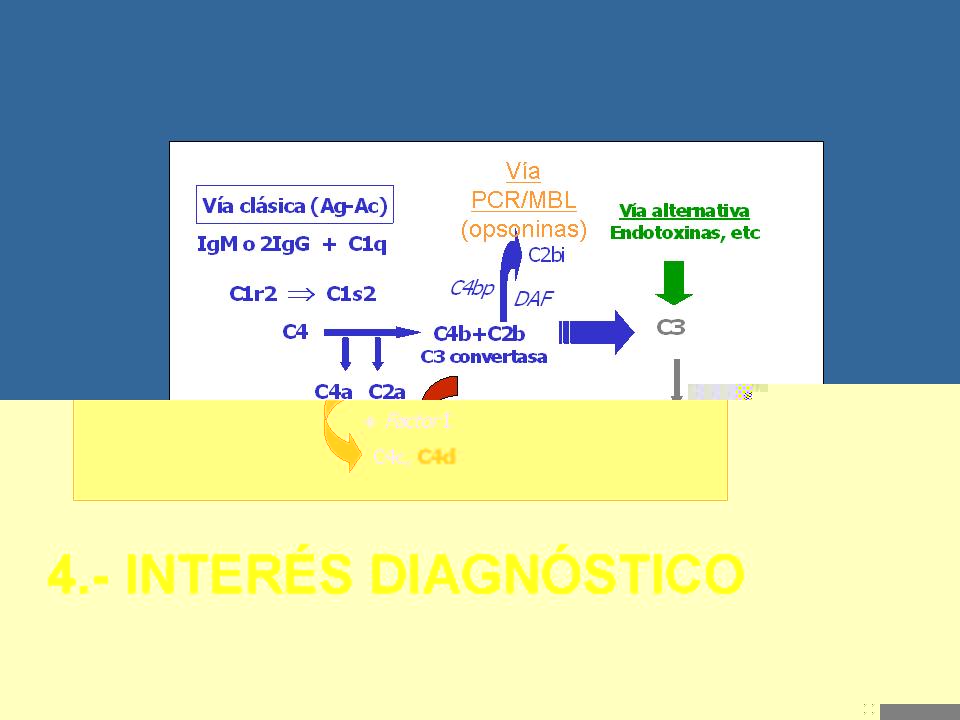
Desde el punto de vista del interés de diagnóstico
Diapositiva número: 25

Pues yo creo que Banff lo ha definido muy bien, el diagnóstico cada vez está más claro. Se ha desarrollado ya en la última., en la última no porque la última fue la de La Coruña de junio, pero en la penúltima reunión en Banff 05 se amplió y se definió perfectamente el rechazo acelerado por anticuerpos tanto agudo como crónico con los criterios que hemos comentado.
Diapositiva número: 26
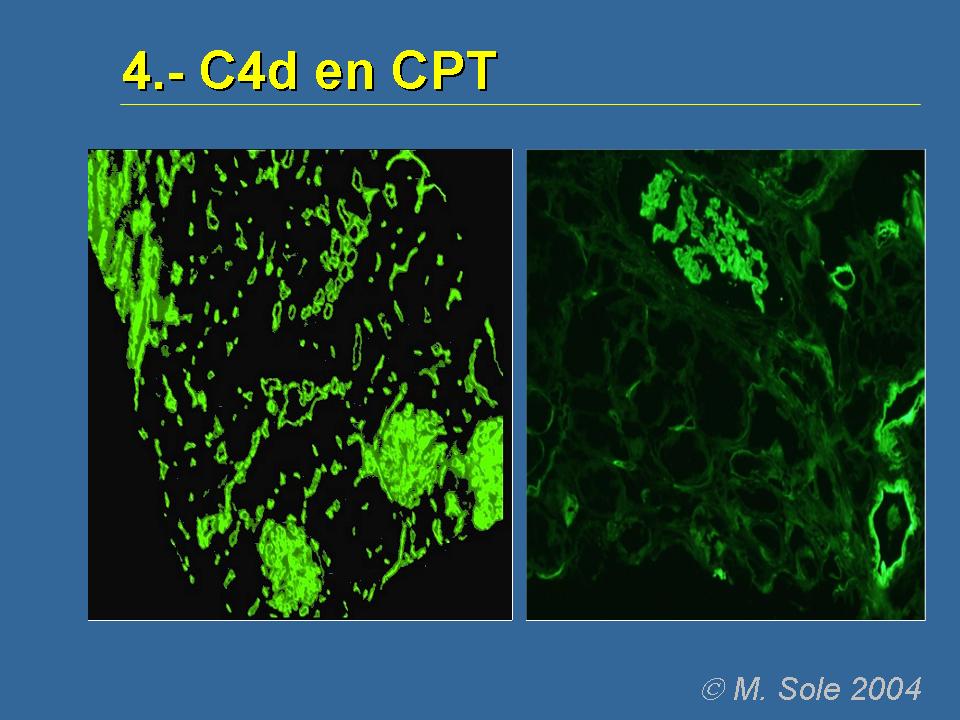
¿Qué decir con respecto al marcador estrella, que es el C4d? Pues que cuando se hace por técnicas de inmunofluorescencia, pues como dice el Dr. Sole, el patólogo con el que yo he trabajado, pues es algo estupendo porque es que se ve claramente. O sea, si lo hay, pues uno ve todos los capilares peritubulares claramente marcados y si no, pues no ilumina. Y cuando se trabaja con inmunofluorescencia, pues hay que trabajar con muestras congeladas y hay que utilizar alguno de los anticuerpos monoclonales que están comercializados en el mercado.
Diapositiva número: 27

Pero hay patólogos o hay grupos que prefieren trabajar con inmunohistoquímica, y con inmunohistoquímica que tenemos, pues tenemos que las muestras congeladas, podemos utilizar tanto el anticuerpo policlonal como el monoclonal, pero si utilizamos muestras parafinadas que es lo que quiere mucha gente para no tener que perder una parte de la muestra de la biopsia para la congelación, pues sólo podemos utilizar el anticuerpo policlonal, porque el monoclonal en general no funciona. Aunque hay un grupo del Insular de Las Palmas que ha conseguido que funcione, pero nosotros no hemos podido reproducirlo en Barcelona.
Y lo que es muy interesante es que hasta hace muy poco sólo existía la serie esta del grupo de Viena que había comparado las biopsias y que decía que había una buena correlación entre la inmunohistoquímica con las distintas muestras congeladas, parafinadas, etc. Pero a mí me parecía que era muy interesante hacer un estudio amplio de biopsias comparando la inmufluorescencia, la inmunohistoquímica, los distintos marcadores y demás. Y bueno, pues estos dos grupos consiguieron hacerlo y, en general, lo que dicen es que la correlación entre las distintas técnicas es muy buena, pero sobresale la inmunofluorescencia. Es decir, que la mayor sensibilidad es para la técnica de inmufluorescencia con anticuerpo monoclonal. Esto no quiere decir que la otra técnica no valga ni mucho menos, pero sí que subrayan todos que la inmunohistoquímica es más subjetiva y más difícil de leer.
Además, algo que no he comentado que yo creo que todos sabemos, la atención del ______ glomerular con cualquiera de las técnicas más inespecífica o más diagnóstica, pero la atención de los capilares glomerulares con inmunohistoquímica se cree que podría tener algún valor.
Diapositiva número: 28
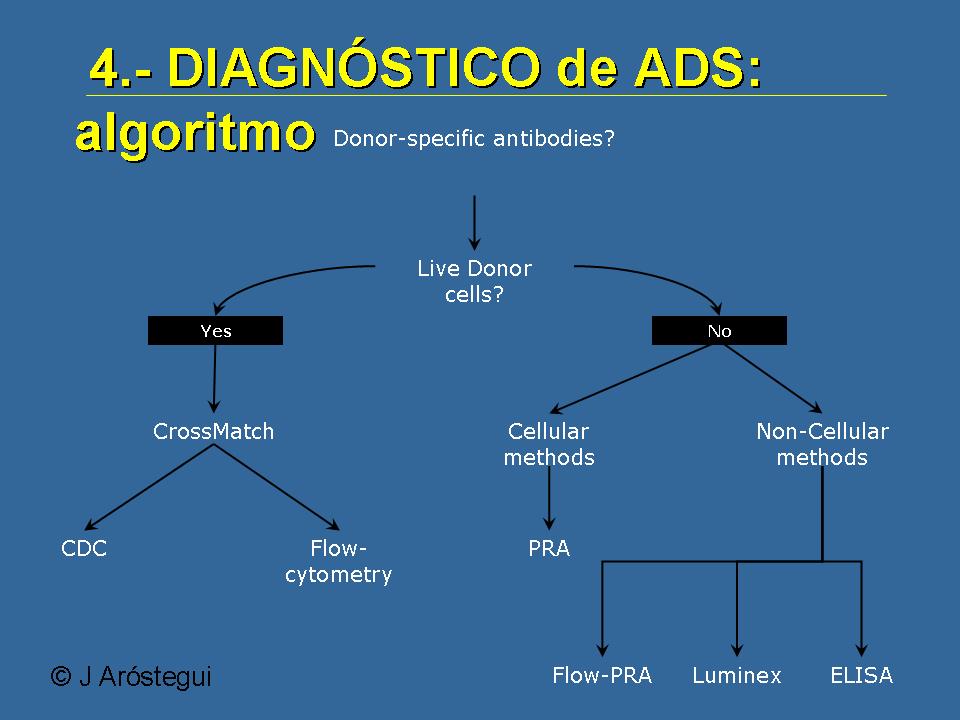
Y desde el punto de vista de los anticuerpos donante-específicos, lógicamente voy a pasar súper rápido porque van dos inmunólogos detrás de mí, no quiero meter la pata, pero esto es un algoritmo de un compañero inmunólogo del Hospital Clínico. Si queremos hacer un estudio de anticuerpos donante-específicos pues podemos tirar de las células del donante si las tenemos, o podemos aplicar una serie de técnicas que lo que van a hacer es inferir si hay o no anticuerpos partiendo de antígenos purificados o de de métodos celulares.
Diapositiva número: 29

De forma muy rápida, y porque los clínicos muchas veces cuando revisamos las publicaciones al respecto, pues no tenemos muy claro cuáles son las técnicas. Lo que hace la citotoxicidad mediada por complemento es detectar anticuerpos que se unen a la membrana de las células del donante y son capaces de matarlas, son anticuerpos claramente citotóxicos. Mientras que cuando hablamos de citometría de flujo, lo que detectamos son anticuerpos que se unen a la membrana de los linfocitos T o de los linfocitos B, que no sabemos si son patogénicos o no, y lo mismo cuando hablamos de la Elisa, son anticuerpos que se unen a antígenos purificados.
Diapositiva número: 30

Y esto lo he puesto porque yo creo que es lo que está de moda hoy en día. La gente en general, y sobre todo en el estudio del rechazo humoral crónico, pues no cuenta con células del donante porque esto es muy complicado, por almacenamiento y porque además, el paciente que te hace un rechazo crónico se trasplantó a lo mejor hace 10 años. Con lo cual tenemos que utilizar unas técnicas que nos permitan aproximarnos a ver si hay o no anticuerpos donante-específicos. Y la citometría de flujo nos permite hacer un análisis general para ver si hay anticuerpos generales o no, pero también nos permite ver si hay anticuerpos frente a antígenos purificados. Lo que comentaba antes, frente a la I, frente a la II o al DR III o lo que sea.
Y lo que se ha puesto muy, muy de moda en todas las publicaciones en Estados Unidos y que yo creo que ya ha llegado aquí también, es el uso del Luminex. Que el Luminex no es más que un citómetro de flujo más sofisticado que permite realizar múltiples análisis al mismo tiempo, que yo creo que está facilitando el trabajo y que veremos, pero que los inmunólogos nos digan realmente los valores que nos da esto.
Diapositiva número: 31

Y desde el punto de vista práctico
Diapositiva número: 32

Diapositiva número: 33

Este yo creo que sería el caso típico. Un chaval de 20 años, con una nefropatía congénita, que se trasplante por primero vez en el año 97, que además recibió múltiples trasfusiones, que hace que adquiera el virus D, es decir, un paciente de riesgo.
Diapositiva número: 34

Un paciente que se trasplanta por primera vez en el 91 y que lo trasplantamos de nuevo en el 2002.
Diapositiva número: 35
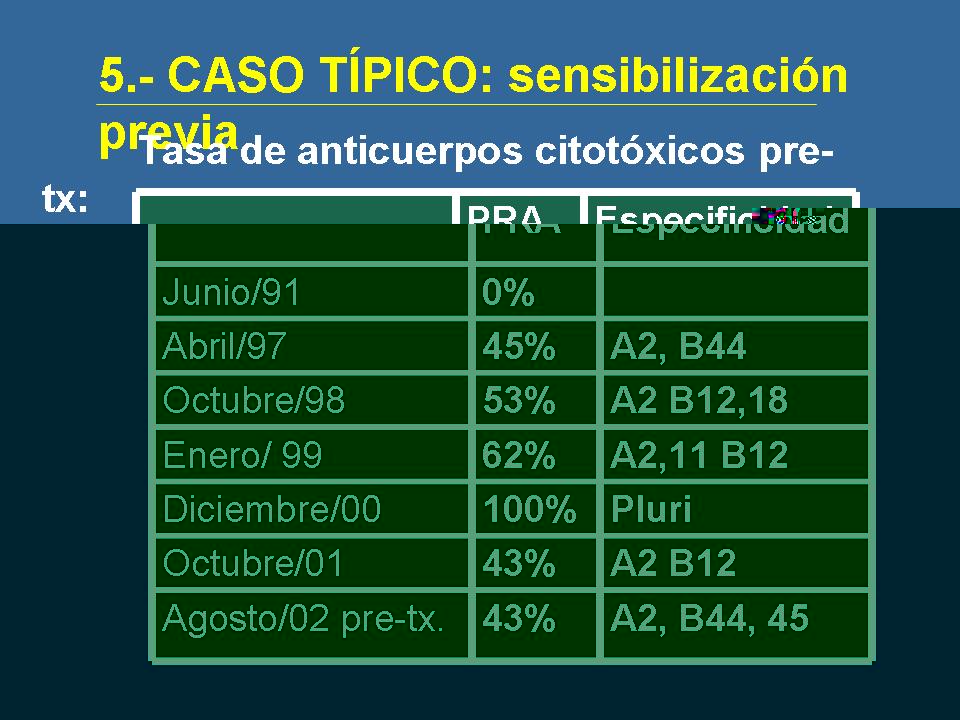
Como vemos, es un paciente que hasta el 91 cuando se trasplanta no tiene aparentemente anticuerpos aunque sí que debería haber recibido transfusiones, sobre todo por la época en la que se trasplantó, pero que a raíz de perder el segundo injerto vemos que tiene una tasa de anticuerpos muy significativa, que fundamentalmente son una dosis de A2 y B44 que no se ha bajado el nivel, pero que son dos de los antígenos del primer donante.
Diapositiva número: 36
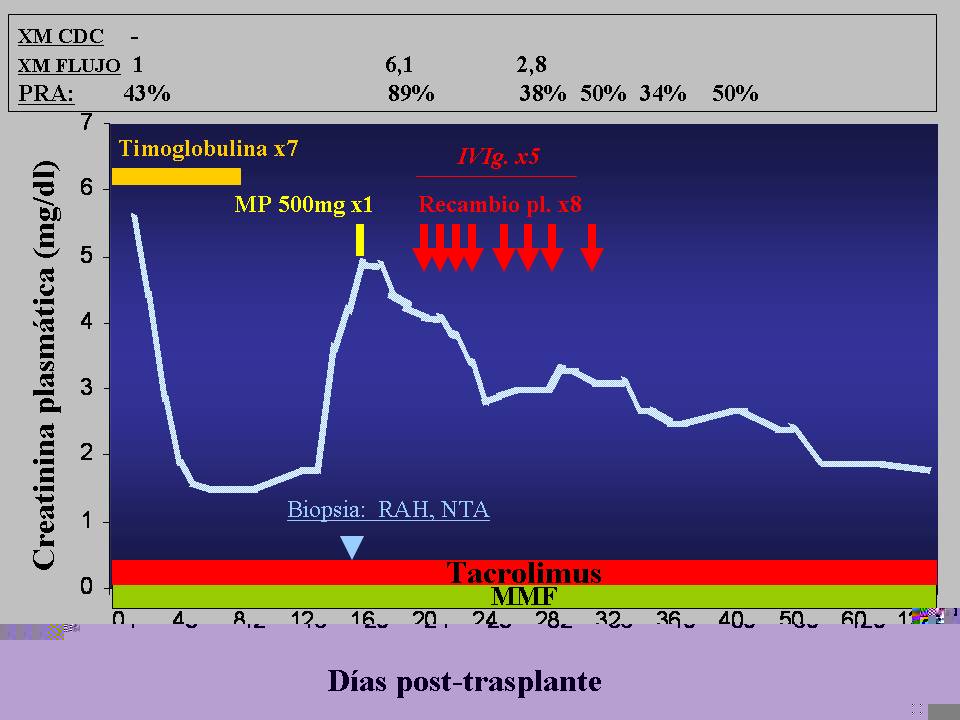
Y este paciente tiene un curso inicial excelente, recibe una inmunosupresión muy potente con timoglobulina, con tacrolimus y micofelanato, se va a su casa, pero 2 o 3 días después de ir a casa vuelve a urgencias con un cuadro de anuria. Hasta que se realiza la biopsia renal y que se repite el cross-match post-trasplante, pues se administran esteroides de esteroides y cuando se obtiene el resultado de la biopsia se ve que no hay ni un solo dato de rechazo celular, que sólo hay datos de rechazo humoral, en el sentido en que tiene datos de isquemia en el injerto y C4d, y algún neutrófilo en los glomérulos. No hay más, con lo cual se realiza el tratamiento con recambios plasmáticos. Como veis aquí, el cross-match pasa de ser negativo pretrasplante a ser positivo post-trasplante. Se trata y se va negativizando el cross-match y va mejorando la función del injerto. Además, este C4d que es positivo aquí, unos meses después cuando se vuelve a biopsiar, pues ha desaparecido.
Diapositiva número: 37
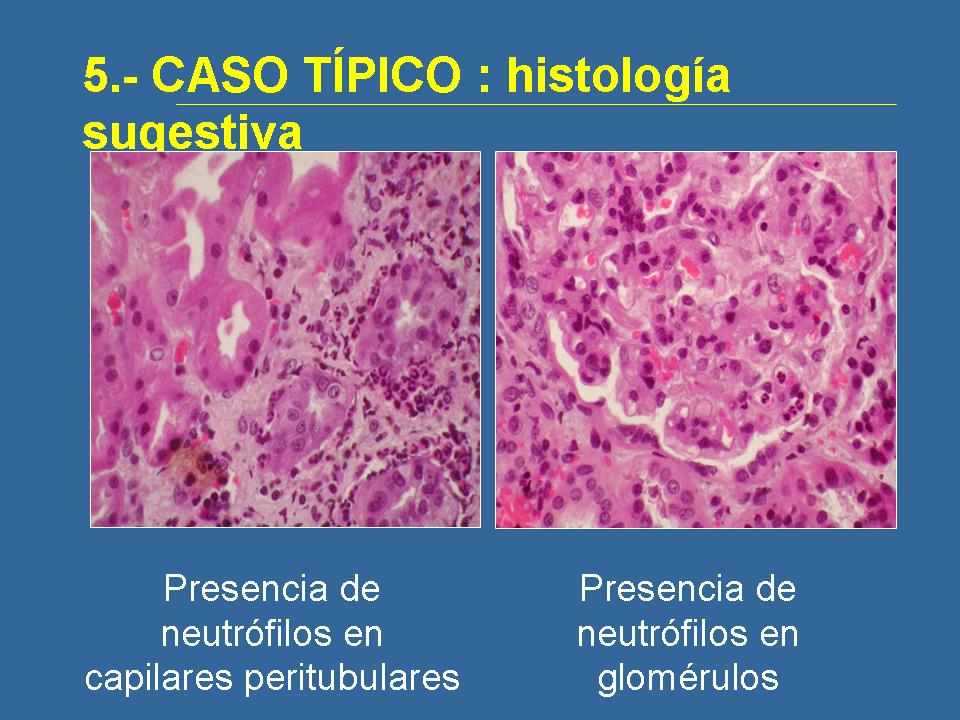
Estas son imágenes de la biopsia de este joven
Diapositiva número: 38
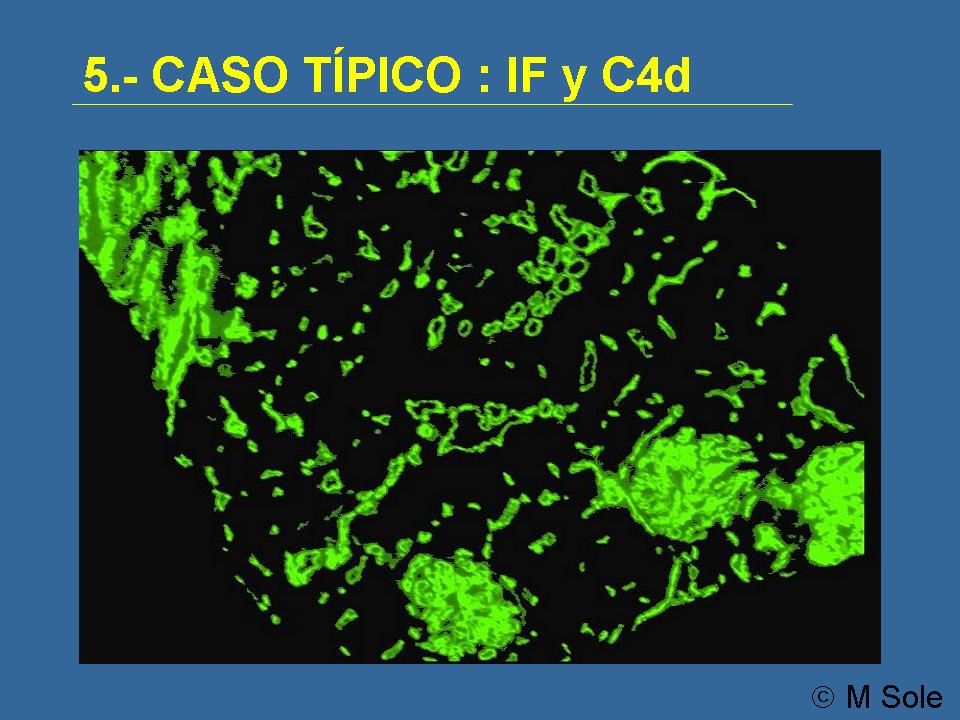
y el C4d
Diapositiva número: 39

Un caso atípico
Diapositiva número: 40

Para que no pensemos en el humoral en los casos típicos en los que seguro que vamos a pensar. Una mujer de 71 años que lleva poco tiempo en diálisis -cuando se trasplanta-, que no ha recibido transfusiones y que tiene unas ______ de 0, como veremos después, y que el único factor que encontramos sensibilizador es que ha tenido dos embarazos a término, que tiene dos hijos.
Diapositiva número: 41

Se trasplanta de un donante con una compatibilidad escasa, puesto que es una mujer mayor en la que priorizamos un trasplante con un tiempo de isquemia corto, con un donante mayor para un receptor mayor, como os digo, los anticuerpos por trasplante son de 0%
Diapositiva número: 42
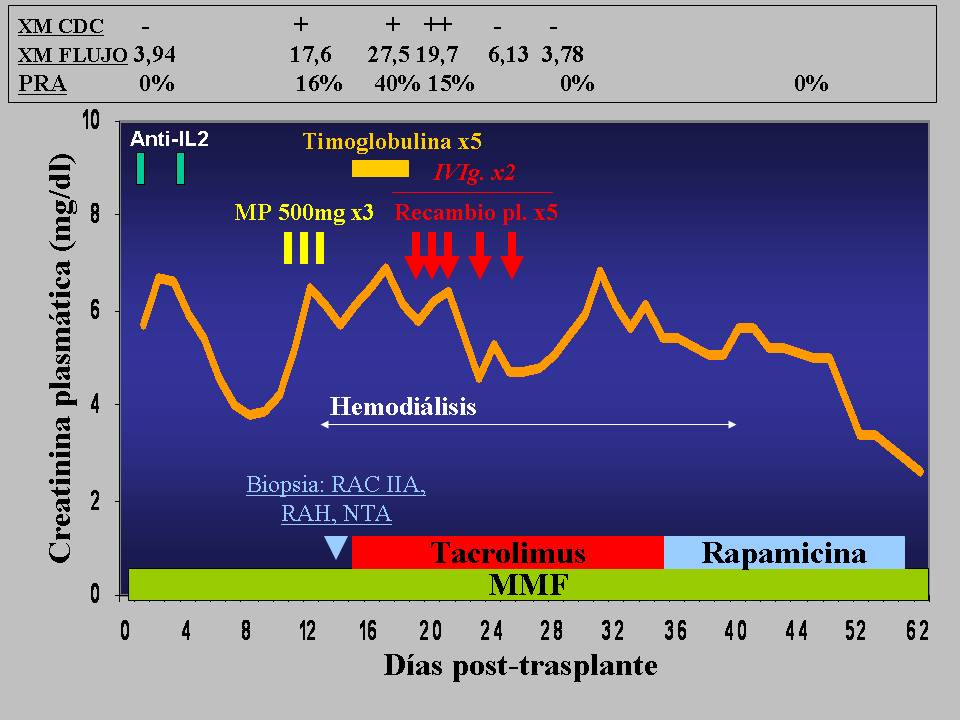
se hace una inmunosupresión light, que era la que utilizábamos en esa época en donante-receptor añoso, con ______, micofenolato y corticoides. Y la evolución inicial parece bastante buena, pero sin embargo hace un rechazo muy severo hacia el día 10 post-trasplante en que hay rechazo celular II, hay rechazo humoral, y se trata con los esteroides, se utiliza timoglobulina porque hay un rechazo celular II A, no porque haya un rechazo humoral, desde nuestro punto de vista, y se utilizan los recambios plasmáticos y se consigue una mejoría. Como vemos, al hacer el cross-match retrospectivo con el suero pretrasplante con citometría de flujo, porque habitualmente se hace con citotoxicidad, pero cuando hacemos un post-trasplante cogemos el suero pretrasplante y lo pasamos por el citómetro otra vez, pues resulta un cross-match ligeramente positivo. Habremos trasplantado, bueno, pues con un cross-match ligeramente positivo que la citotoxicidad no nos había dado.
Diapositiva número: 43

Un caso refractario.
Diapositiva número: 44

Un paciente que recibe un tercer trasplante renal junto con un trasplante hepático, un caso del Dr. Torregrosa que está ahí enfrente. Es un paciente que recibe el tercer trasplante en el año 2004 y que lo recibe con un cross-match positivo, a propósito. Porque era un paciente que va a recibir un hígado y por las series que habíamos revisado en Estados Unidos, pues parecía factible trasplantarlo con cross-match positivo al poner un hígado, porque existe la teoría de que el hígado, ente comillas, de forma muy poco científica, "protege" al riñón, o sería capaz de absorber esos anticuerpos circulantes. La evolución inicial es excelente, pero hace un rechazo muy severo hacia los 10 días del trasplante. Un rechazo que, claro, hacemos el cross-match y nos encontramos con anticuerpos, pero no sabemos si esos anticuerpos los tenía antes del trasplante, lo sabíamos, no sabemos si tiene un papel patogénico o no, pero la biopsia renal nos muestra C4d.
Diapositiva número: 45
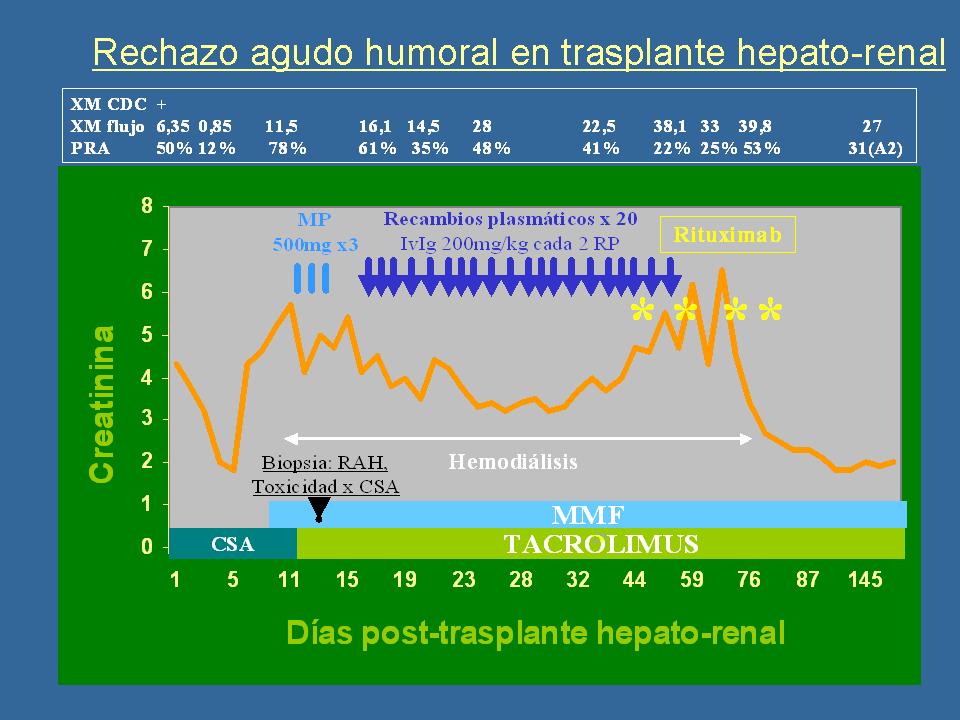
Y este es el curso de este paciente. Lo trasplantamos con cross-match positivo, el cross-match se negativiza a los 5 días del trasplante, pero con el rechazo vuelve a positivizarse. Tiene su C4d, le hacemos -como veis- veinte recambios plasmáticos y no había manera, y el paciente en diálisis, y dijimos "bueno, si hay alguna opción vamos a utilizar el Rituximab". Bueno, pues fue el Rituximab, fue el tacronicofelanato, fue. No lo sabemos, la verdad es que la función renal del paciente mejoró. Dejó la diálisis, alcanzó una función renal, pues no excelente, porque según aclaramiento quedó bien alrededor de 30, pero bueno, un riñón funcionante. No sé si el aclaramiento de 30 fue por un tratamiento tardío o, bueno, porque había mucho daño en el riñón. Pero bueno, es interesante y sí que empezamos a pensar que el Rituximab, pues sí que tenía algún papel.
Diapositiva número: 46

Y como caso crónico, pues es muy difícil.
Diapositiva número: 47

Esta también es una paciente del Dr. Torregrosa, que los aglutina todos estos pacientes complicados. Es una chica de 21 años, no es un caso nuclear, pero bueno, lo voy a contar. No tiene antecedentes de embarazos, no sé si ha recibido trasfusiones pero tiene un virus C, probablemente las recibió, y tuvo un primer trasplante renal en el año 96.
Diapositiva número: 48

Como vemos, recibe en febrero de 2004 un segundo trasplante renal con una compatibilidad excelente. Sólo recibe de incompatibilidades el DR 60 y el DR 13 y no repite incompatibilidades con el donante anterior. Es una paciente sensibilizada, pero bueno, no una cosa muy llamativa. Unos PRAs del 19%, 12%, esta A III que era del donante previo, 6% y en el momento en que la trasplantamos un 0%.
Diapositiva número: 49

La paciente hace una evolución inicial tórpida, con una función retrasada de injerto, un rechazo de IA que se trata con corticoides, pero en la biopsia, cuando se está resolviendo el rechazo IA se observan depósitos de C4d en los capilares peritubulares. Se hace un cross-match por citometría de flujo y es negativo para clase I y para clase II, y el cuadro se resuelve y la mejor creatinina que alcanza es 1,2 mg/dl. Sin embargo, hacia un año después empieza a presentar un deterioro progresivo de la función renal, con una proteinuria muy llamativa, se rebiopsia, vuelve a aparecer ese C4d con una nefropatía crónica avanzada, con una glomerulitis, y esta vez el cross-match con clase I es negativo, pero con clase II es positivo. Se administra una dosis de Rituximab y lo único que sabemos de momento es que el injerto sigue funcionando, mantiene unas creatininas de 2,7, no ha tenido una proteinuria reciente y por eso no está aquí, y hay algún otro paciente en el que hemos hecho esto. Claro, con estos casos tan aislados es muy difícil llegar a una conclusión.
Diapositiva número: 50

Pero de la charla yo que tal vez sí que se puede llegar a conclusiones.
Diapositiva número: 51

Y es que, bueno, tenemos unos criterios diagnósticos claros para el rechazo agudo humoral. Las pautas de tratamiento, si bien son eficaces no están convenientemente evaluadas y es difícil hacerlo, nuestra población en lista de espera cambio y puede que aumente la incidencia del rechazo, hay que tenerlo en cuenta. El diagnóstico precoz es muy importante, yo creo que todos debemos hacer C4d y tener la posibilidad de detectar anticuerpos. Los autores hoy en día lo que es están diciendo es que habrá que determinar ser más o menos agresivo con el tratamiento dependiendo de los grados de severidad, a lo mejor de los factores de riesgo estos que decíamos antes. Si el PRA es muy alto, a lo mejor Rituximab a la entraba. Que el humoral crónico se puede diagnosticar adecuadamente, pero que el tratamiento es un interrogante porque como no sabemos qué estamos tratando, probablemente el cuadro es demasiado amplio y variado.
Diapositiva número: 52

Y cosas que están de moda, pues lo de las hemaglutininas, el tema del trasplante de ABO incompatible o con cross-match positivo, pues que Estados Unidos se está haciendo en números importantes. Aquí, bueno, pues hemos llegado a hacer algún ABO incompatible, también los anti-MICA, como he comentado al principio. Algunos grupos han hecho estudios interesantes con el C3d y parece que el C3d si aparece en las biopsias junto con el C4e podría tener un interés pronóstico: hablaría de un peor pronóstico, de una mayor severidad del rechazo, pero bueno, hace falta estudios más amplios. Y lo que os comentaba antes, que para el tratamiento hay que tener en cuenta las características clínicas, que a lo mejor, bueno, pues es como todo lo que hacemos en la clínica, que no es matemático, que dependiendo, aunque tengamos un humoral, pues probablemente hay desde humorales más leves hasta humorales más severos.
Diapositiva número: 53

Y nada más. Muchas gracias por la atención.
|



