Diapositiva número: 1

Buenas tardes. En primer lugar agradecer la invitación por parte del comité organizador para estar aquí hoy con vosotros, agradecer igualmente la presentación de la Dra. García, se nota que trabajamos juntos y tal. Y bueno, he de confesar que es la primera vez que me dirijo a un foro exclusivamente de nefrólogos. Como en todas las primeras veces, pues uno no sabe muy bien cómo afrontar la cosa, sólo espero que los que aquí estáis algo de utilidad podáis aprender. Me voy a dedicar a temas de investigación, fundamentalmente, más que nada voy a lo que hacemos en el laboratorio diariamente.
Diapositiva número: 2

El objetivo principal, podemos decir, así ya a largo plazo de todos los que estamos involucrados en el tema del trasplante, lógicamente es que esos trasplantes sean al más largo plazo posible. A poder ser como este que es el que se realizó en Boston, la noche de Navidad del 54, por el grupo de Murray, Merryl y Harrison, que tuvo una larga vida, pero claro, eran gemelos idénticos y así cualquiera, ¿no?
Diapositiva número: 3
La verdad es que todos los días lo que nos encontramos es otra situación, un individuo no totalmente compatible, pues lógicamente hace que de desencadenen respuestas inmunes frente a las mismas.
Ya la Dra. Crespo, Marta, habló del papel de Terasaki y de Patel, con la introducción de test de citotoxicidad, que eventual viene siendo de obligada realización la prueba pretrasplante. Desde 1969 prácticamente hay muy pocas modificaciones hasta nuestros días, treinta y tantos años después.
Diapositiva número: 4

¿Cómo se llega a un cross-match positivo? Pues importantes, son los elementos inmunizantes más., con mucho son las transfusiones, los embarazos, la historia obstétrica es importante, y los trasplantes previos, que son situaciones en las que entramos en contacto con antígenos extraños para el receptor.
Diapositiva número: 5

En el laboratorio nuestro de compatibilidad, llevamos a cabo en el estudio pretrasplante dos tipos de aproximaciones fundamentalmente, que es la monitorización de anticuerpos circulantes periódica y después la realización de pruebas cruzadas previas al trasplante.
Diapositiva número: 6

La monitorización de anticuerpos circulantes tiene como principal objetivo, pues mediante él hacemos el cálculo del PRA y hacemos la identificación de anticuerpos, de la especificidad del anticuerpo si estuviera presente. El objetivo es la evaluación del riesgo inmunológico y una interpretación de la prueba cruzada. Mediante la realización de pruebas cruzadas, lógicamente, intentando evitar el rechazo y pérdidas de injerto.
Diapositiva número: 7
¿Dónde comienza la evaluación pretrasplante de un posible receptor? Pues comienzo para nosotros, pues en lo que es la solicitud de extirpaje, en el sentido de que es muy importante que nos indiquen si ha habido transfusiones previas. Es decir, elementos inmunizantes, si ha habido la historia obstétrica y también, pues la enfermedad primitiva, sobre todo a la hora de considerar la posible existencia de anticuerpos. Por ejemplo, en una nefropatía lúpica te pone un poco más en guardia de que puede haber otros anticuerpos.
Y aprovecho aquí también para recordar que cuando algún paciente en lista de espera se trasfunda, de verdad que es importante que os hagáis el suero post-trasplante, o sea por transfusión, y que lo comuniquéis para poderlo estudiar porque es importante a la hora de evaluar después una prueba cruzada, tener conocimientos de los elementos inmunizantes que ha tenido cada paciente. Yo recuerdo casos en los que, bueno, un paciente en lista de espera para un estudio citotóxico en 3 años siempre continuamente negativo y nos plantemos, entró en prueba cruzada y se decidió, como estaban todos los estudios y eso negativos, pues se pensaba que como era negativo no iba a haber ningún problema, incluso se pensó en algún momento no esperar al suero porque es una posibilidad si tiene estudios negativos siempre, pues puede ser cromáfobos con los sueros que tiene previos, pero para nuestra sorpresa, solicitamos en esa ocasión el suero actual y era clarísimamente positivo. Y fue a posteriori cuando nos enteramos que ese paciente había recibido una transfusión.
Diapositiva número: 8

¿Cómo se hace? Bueno, el técnico de toxicidad -digo tal y como lo escribió Terasaki- se extraen linfocitos de la persona, se enfrenta frente a suero, se incuba y trae periódico ______ que el anticuerpo reaccionaba con el antígeno va a producir lisis celular y si no hay reacción, pues al anticuerpo no mata a la célula.
Diapositiva número: 9

El equipamiento, no obstante, es sencillo, con un microscopio y con una pipeta que nosotros tenemos, esto es una foto de Hamillton, y las placas de Terasaki.
Diapositiva número: 10

¿Cómo calculamos el PRA? Estas son unas lecturas de un estudio citotóxico. Cada columna corresponde a un suero y, bueno, estos son tipajes de pacientes que tipamos en el laboratorio por otras causas, no sé, donantes de médula ósea, familiares, trasplantes de familia, etc. Y bueno, se enfrentan las células de tipaje conocido frente al suero de los pacientes en lista de espera y se anotan las reacciones positivas con 8 o si no, se deja en blanco si es negativa. Entonces, el cálculo del PRA constituiría nuestro panel de., y bueno, en este caso han sido 8 reacciones positivas de un total de 27.
Para calcular la especificidad hay que sacar factor común de las reacciones positivas, como diríamos. Vemos que todos los que han sido positivos presentan anticuerpos, por tanto la especificidad de anticuerpos ______ 23, no había 23 ni hay 24 en la otra célula, por tanto ese suero reconoce 23 de 24. Aquí hay un caso un poco más dudoso porque hay una reacción, no hay 23 ni hay 24, hay 37 que es la única representación que tiene el panel. Por tanto, más dudoso es. Un poco para mostrar las limitaciones de lo que es el PRA.
Diapositiva número: 11

Bueno, después vemos, como no hay ninguna reacción PRA de 0, después nos encontramos con PRA del 100%.
Diapositiva número: 12

¿Un PRA de 0 quiere decir que no hay anticuerpos? Pues no, posiblemente no, porque eso lo vemos en anticuerpos fijadores de complemento, sólo estudiamos anticuerpos que están en linfocitos, puesto que lo que se incuba con el suero son linfocitos y títulos bajos es que los anticuerpos no sean capaces de llegar a tener cantidades suficientes como para fijar complementos y producir la lisis celular. ¿Que sea un PRA mayor de 0 es que hay anticuerpos potencialmente dañinos? Pues tampoco, porque es posible que existan otros anticuerpos de ese tipo de genes, que claramente no son dañinos para el receptor, se puede trasplantar tranquilamente teniendo ese tipo de anticuerpos.
Diapositiva número: 13
¿Qué ha supuesto esto? Lo venimos viendo desde Terasaki, ha supuesto una revolución en el estudio de anticuerpos la introducción de un método basado en fase sólida, que se llama. El fundamento es que se cogen las moléculas de interés, fundamentalmente HLA, pero como hemos visto ahora hay otras moléculas que no son HLA que también intervienen como pronóstico en el trasplante y, por tanto, también se pueden aislar, y fijar a una fase sólida. Hay como 3 tipos fundamentales, está el Elisa cuando se fija a un pocillo de plástico, luego se incuba con anticuerpos, que se revele y cuando hay color quiere decir que hay anticuerpos frente a la molécula HLA que se ha colocado en ese pocillo, y después las que están más en uso, está el PRA que es mediante citometría de flujo convencional, digamos. Una bolita donde se fijan las moléculas HDA amplificadas y después se pasan por un citómetro, que es el que se usa normalmente para hacer poblaciones linfocitarias, por ejemplo.
Y ya, lo que realmente supone una auténtica revolución, que está cambiando mucho la forma como enfrentamos en estudio pretrasplante -y post-trasplante también, pero bueno, como estamos hablando del pretrasplante- es la tecnología Luminex, son también bolitas de poliestireno, las cuales se fijan a las moléculas purificadas, donde ahí van a ser reconocidos ya todos los anticuerpos si es que están presentes en el suero del paciente.
Diapositiva número: 14
Un poco esa sería una microesfera de Luminex a la cual le fijamos el antígeno que queramos, se incuba con el suero, ese anticuerpo se va a fijar y este recién se revela como otro anticuerpo marcado con un fluorocromo.
Diapositiva número: 15

En comparación con el equipamiento que utilizamos para el CDC, la verdad es que nuestro problema es el citómetro para hacer un PRA. Esto es el Luminex.
Diapositiva número: 16
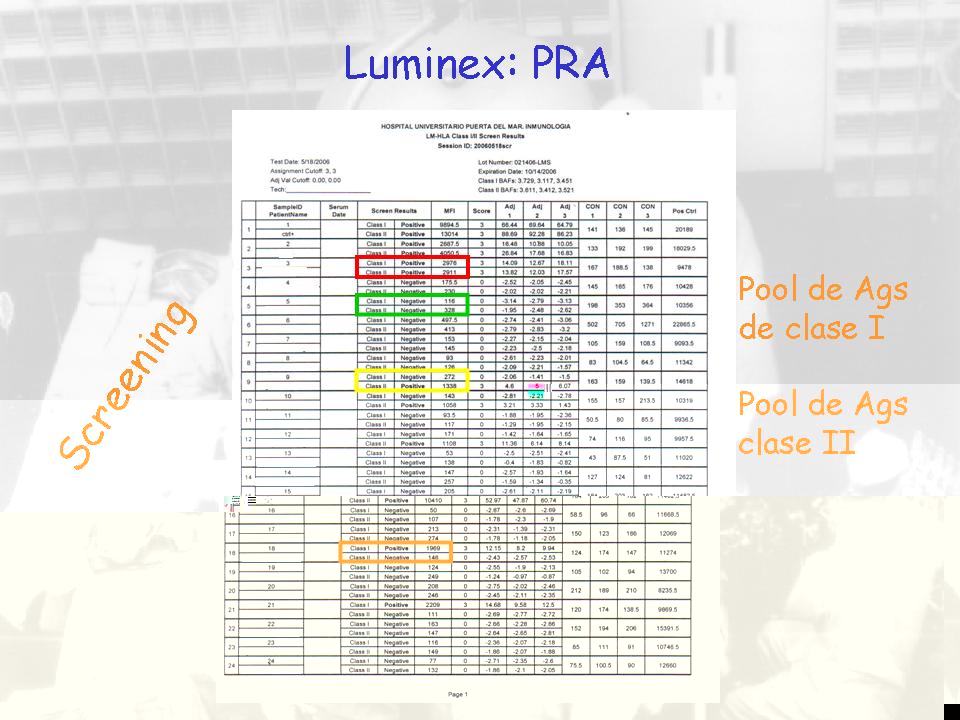
¿Cómo calculamos el PRA mediante Luminex? Pues nos permite primero hacer un screening. Un screening para saber si el paciente tiene anticuerpos anti-clase I o anti-clase II, cosa que eso no lo pueden hacer con los CDC convencionales. Ya es un avance, es decir, tú puedes detectar de entrada, sin saber escecifidad ni nada, si un paciente tiene anticuerpos anti-clase I o anti-clase II. Aquí tenemos un paciente que es positivo para clase I y clase II, uno que es negativo para los dos, un paciente que es positivo para anticuerpos de clase II, negativo para clase I y viceversa. Esto se hace haciendo un pool de todos antígenos HLA de clase I en un grupo de bolita diferenciándolo del pool de bolita de clase II.
Diapositiva número: 17

¿Cómo calculamos la especificidad? Para la especificidad, cada uno de estos representaría un beep y en cada beep, lo que se le fija son los antígenos HLA purificados de una célula. Es decir, se hace un tipaje de una serie similar al CDC en ese sentido y entonces, medidos la fluorescencia de reactividad de cada una de las bolitas con un tipaje, tenemos posibilidades de marcar un cut-off, un positivo y un negativo, que todas estas bolitas tendrías antígenos positivos, antígenos frente a los que el paciente tiene anticuerpos, estos serían negativos.
Diapositiva número: 18
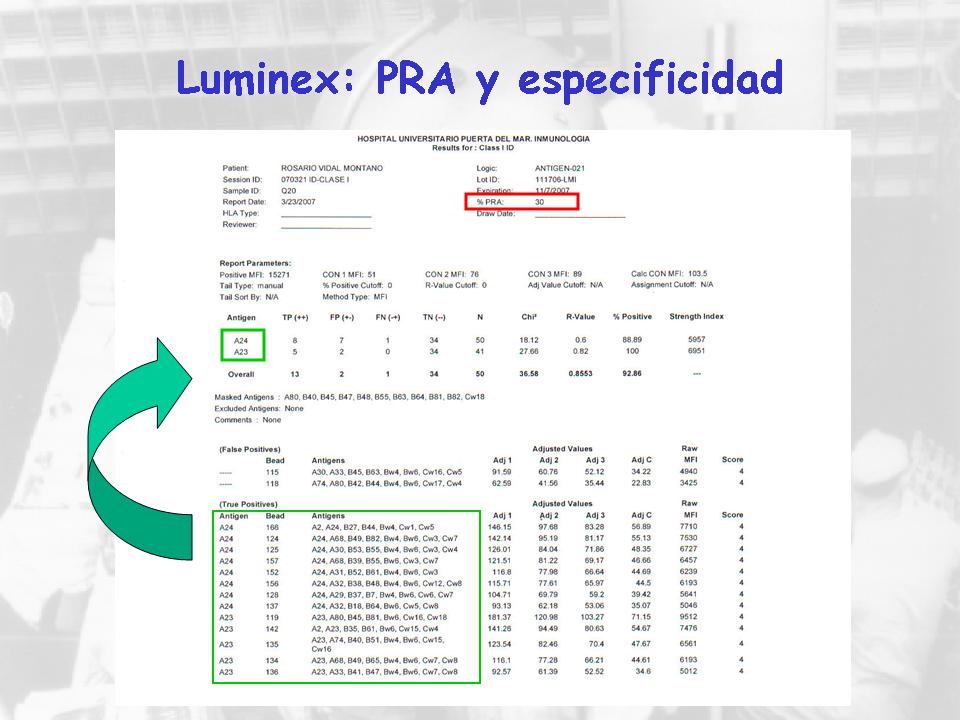
Y el cálculo del PRA y de la especificidad, pues es similar al CDC, digamos. Lo que pasa es que el PRA, por ejemplo, es bastante más robusto, en el sentido de que el grupo de bolitas es constante en el grupo de los pacientes y, bueno, la especificidad tampoco es igual que el CDC. Aquí tenéis la bolita, los antígenos que se le han fijado y el antígeno que comparten las bolitas que han sido positivas.
Diapositiva número: 19
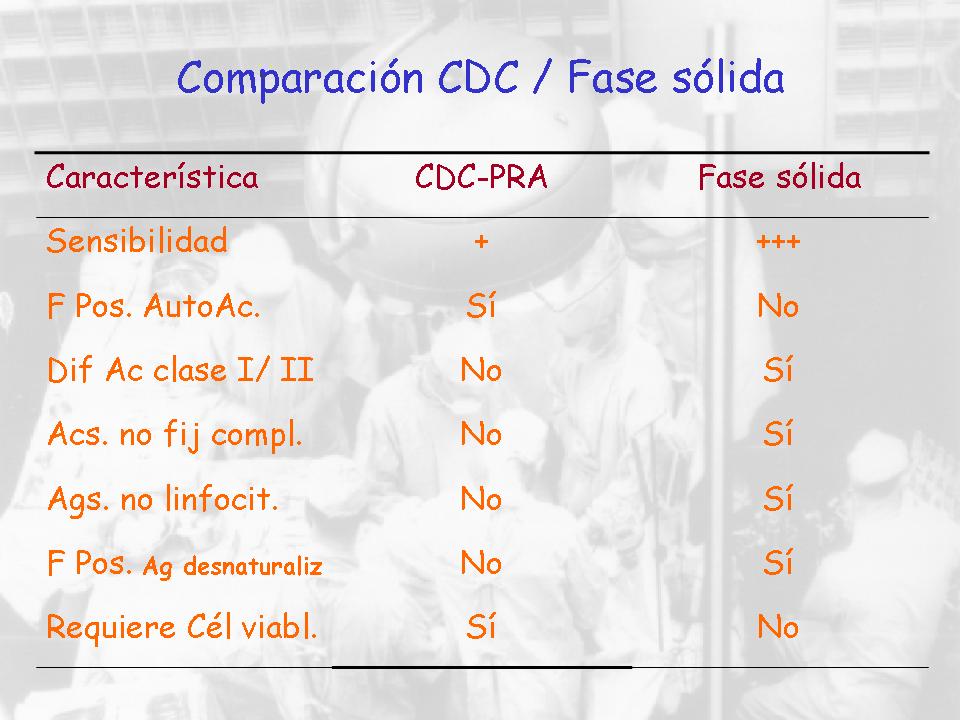
Si queremos comparar un poco el CDC con los ensayos en fase sólida, fundamentalmente Luminex, y hay otras que se están poniendo en nuestro medio, presenta mucha más sensibilidad, no da falsos positivos ni se mezcla con otros anticuerpos, es posible diferenciar antígenos de clase I y de clase II, es capaz de detectar anticuerpos no fijadores del complemento puesto que no se utiliza el complemento en este caso. Es capaz de detectar antígenos linfocitarios, como he dicho. Quizá podemos encontrar algún falso positivo, perdón, por el tema de que cuando tú sacas el antígeno de la célula y lo fijas en una bolita, realmente no sabes o por lo menos no dicen cómo queda, si queda cargado con el péptido, la conformación y tal, y puede ser que nos encontremos algún falso positivo porque el antígeno no esté en la posición correcta, digamos, que se encontraría fisiológicamente en la célula y no requiere viabilidad celular.
Diapositiva número: 20
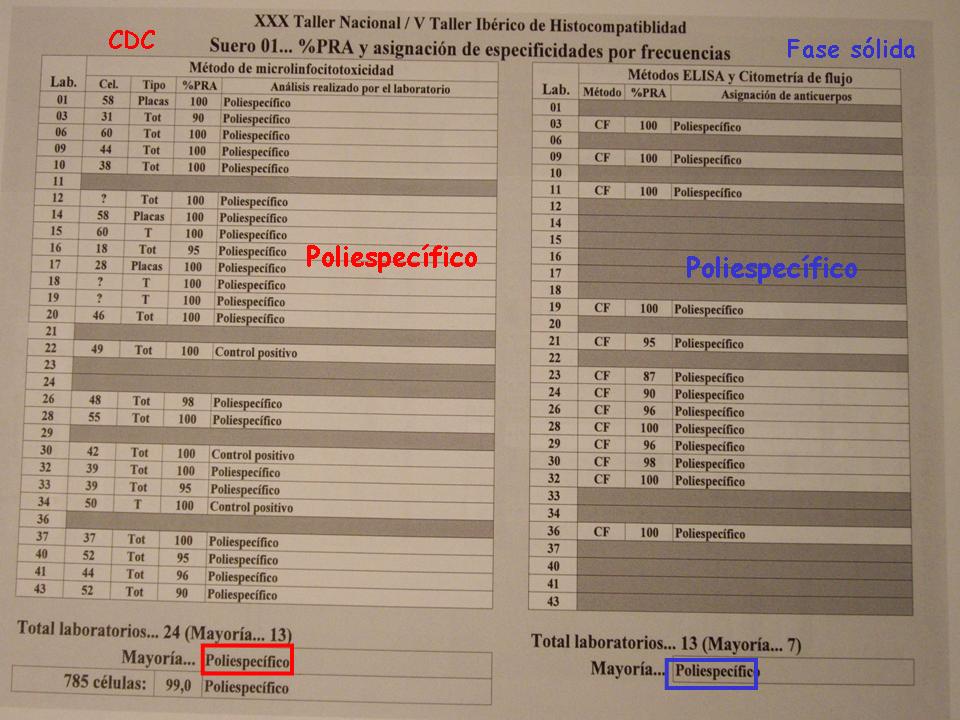
Hay muchos trabajos que comparan CDC y Luminex. Creo que hubiese preferido algo así como más., me pareció más intuitivo utilizar resultados del control de calidad que la Sociedad Española de Inmunología realiza anualmente, ya que los sueros son estudiados por todos los laboratorios de compatibilidades de España y de la región ibérica, también se suman al nuestro y, bueno, pues una idea de cómo pueden funcionar las cosas.
Estos son los laboratorios participantes por técnica de CDC y por técnica de fase sólida. Como veréis, la citometría de flujo utiliza prácticamente muy poco gente en España y con la citometría de flujo, fundamentalmente también Luminex aunque también algunos utilizan fluo PRA. Hay algunos sueros que claramente ______ inmunizar, poliespecífico, tanto por CDC como por Luminex.
Diapositiva número: 21
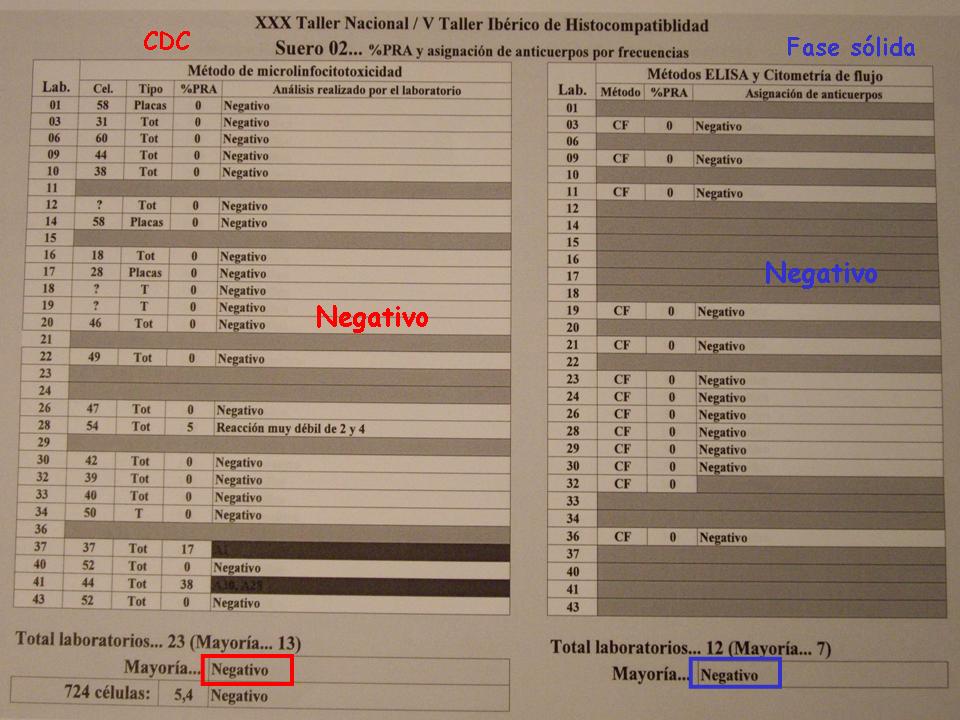
Cuando el suero es negativo hay concordancia
Diapositiva número: 22
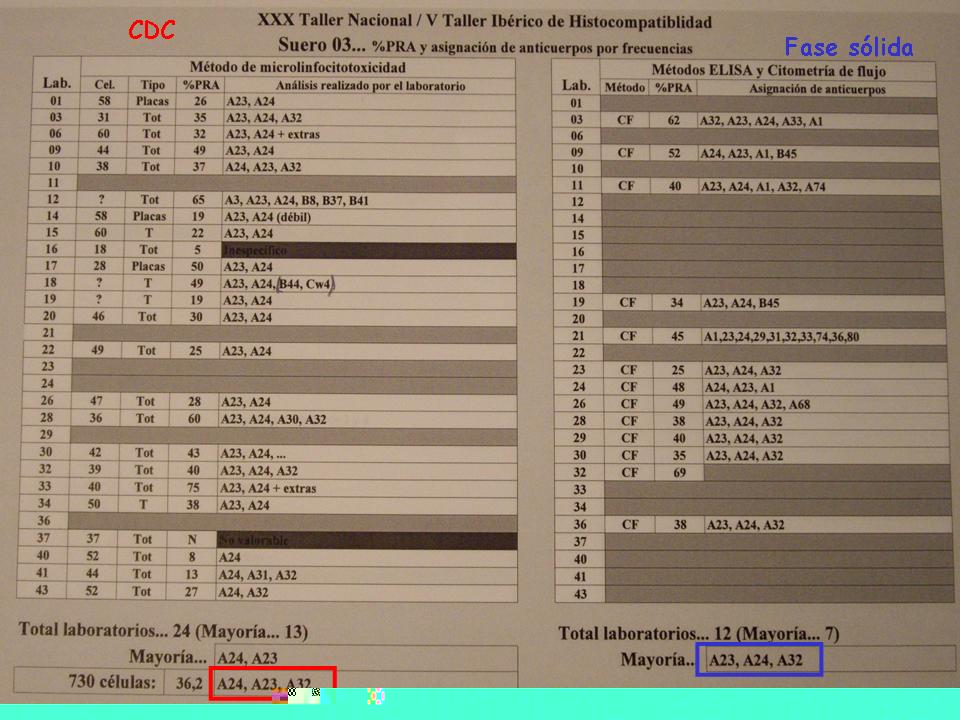
hay algunos en los que detectamos los antígenos y damos concordancia absoluta también, se detecta en todos los laboratorios amabas técnicas concordantes
Diapositiva número: 23
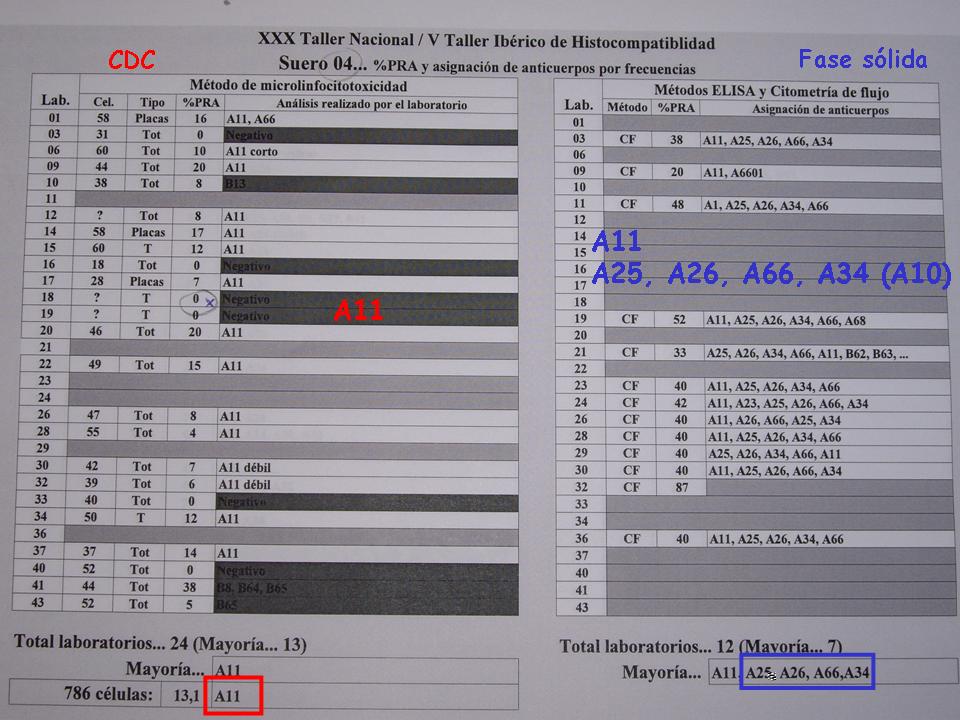
. Entonces ya empezamos a encontrarnos algunos en los que por CDC solamente encontramos A11, la especificidad sería A11, mientras que los han utilizado Luminex, además del A11 con bastante consistencia, digamos, entre unos laboratorios y otros, pues debe esta la especificidad de media como en 25, 26 66,34, que además digamos que tiene sentido porque son todas relacionadas en el grupo del split del A10.
Entonces, bueno, pues ya tenemos alguna información más sobre el Luminex. Ahora, me gustaría saber si es relevante o no.
Diapositiva número: 24

Después, yo creo que esto también es representativo de la mayor sensibilidad del Luminex, como todos los laboratorios encuentran alguno mediante Luminex. Mientras que el CDC, el consenso de todos los laboratorios -se tiene un consenso en función de la célula estudiada y del resultado que han dado- es negativo, pero los laboratorios que han dado una especificidad son de 3 a 1. Estos son, digamos, así de paso detectar algo, pues sí que ha detectado. Posiblemente ese suero, lo que pasa es que las técnicas de CDC son incapaces de detectarlo en la mayor parte de los laboratorios.
Diapositiva número: 25
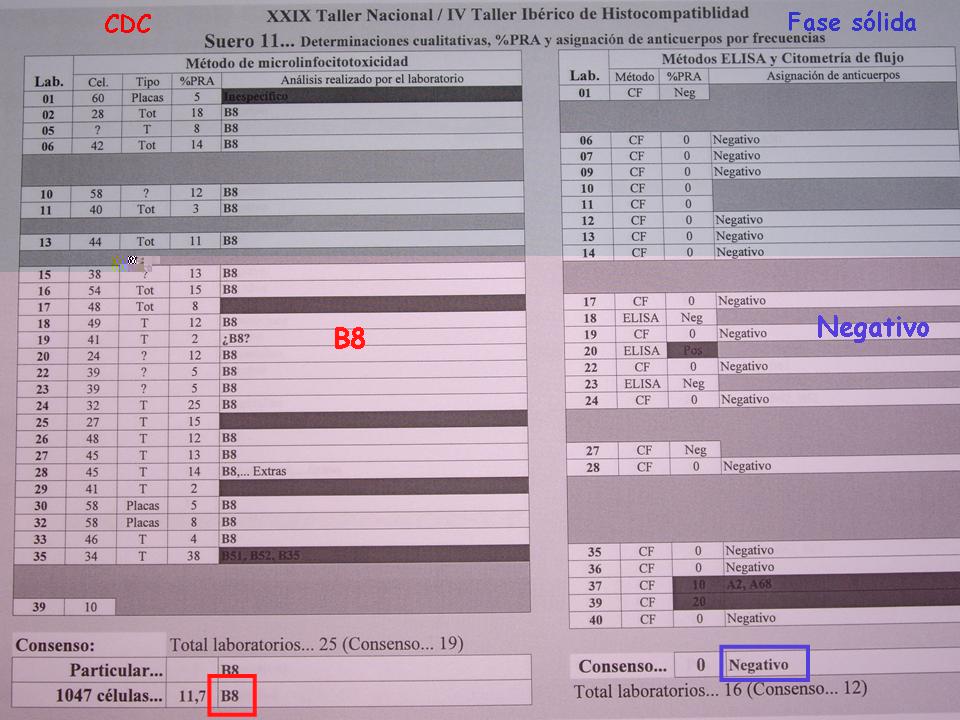
Después también encontramos este caso que es bastante ilustrativo, a mi entender. Como Luminex es absolutamente negativo en todos los laboratorios y en todos los laboratorios, bueno, hay algún otro pero no tiene importancia, digamos que todos encuentran B8.
Diapositiva número: 26

Entonces la pregunta puede ser, ¿por qué se han postulado para sustituir lo que es el Luminex a CDC? Yo creo que toda la técnica CDC resiste treinta y tantos años después y que debe de seguir haciéndose, y que el ensayo en fase sólida de, concretamente el Luminex, debe integrarse en la laboratorio porque realmente ofrece información adicional; yo creo que son complementarias.
Diapositiva número: 27
Y en base a eso, esto es lo que es un poco el algoritmo que seguimos nosotros en el laboratorio y que ya digo que integramos las dos opciones. Todos los pacientes llegan en algún momento, screening por supuesto y CDC. Cuando el screeming es positivo pasamos a identificación, así como cuando el primer CDC es positivo pasamos a identificación mediante Luminex y si por CDC es negativo se hace screeming por Luminex, es decir, vemos si el antígenos es inmusupresor durante los tres estudios del año y una vez al año, no obstante, repetimos CDC por si las moscas. Una vez que nos lo identifica el Luminex también hacemos CDC en todos los estudios posteriores y solamente repetimos la identificación por Luminex si hay cambios en el PRA. En caso de que dé negativo al elemento sensibilizante, no obstante también hacemos identificación por Luminex. ¿Por qué? Porque hemos encontrado casos también en los el luninoscreeming, un conjunto del pool, digamos, del antígenos anti-HLA. Entonces algunos pueden ir algunos menos representados. Y uno puede no estar a un nivel de representación suficiente como para dar positivo y, sin embargo, la identificación, los antígenos están mucho más seleccionados, están más disponibles y es posible que bajos niveles de anticuerpos se puedan detectar mediante la bolita de identificación y pasar desapercibidos por el screeming. Tenemos casos documentados, ¿no?
Diapositiva número: 28
¿Qué más sabemos del Luminex, aparte de lo dicho hasta ahora? Pues posibilidades de detectar single antigens en este caso, son las bolitas lo que llevan, pues son antígenos aislados, purificados, un solo alelo en cada bolita. Con lo cual tú estás viendo cada paciente frente a qué antígenos concreto tiene anticuerpos y cuáles serían aceptables en un posible trasplante. Es decir, si nos damos cuenta, lo que vemos en este resultado es el tipaje del paciente, que efectivamente queda aquí en la zona donde no hay reactividad y junto con otros que en teoría podrían ser utilizados en un trasplante.
Diapositiva número: 29

Y bueno, no he tenido tiempo de preparar la charla del ______ y, efectivamente, yo lo he traído aquí simplemente para resaltar que el estudio, precisamente lo que utiliza para detectar estos anticuerpos es el Luminex.
Diapositiva número: 30
Y la otra parte que nos dedicamos, las pruebas cruzadas. Ya sabéis, ahí vemos unas modificaciones para aumentar la sensibilidad, dividir en gammaglobulina. Sí utilizamos, a lo mejor, un tiempo de incubación más largo en el CDC, que lo recomendamos normalmente, y después también citometría de flujo, que quizá como vamos mal de tiempo no vamos a ver mucho porque tampoco es.
Diapositiva número: 31

Diapositiva número: 32

Sí decir que, bueno, tiene una mayor sensibilidad, que también es capaz de detectar anticuerpos no fijadores de complemento, que se utiliza sobre todo en pretrasplante y que los mejores resultados. Porque se ha hablado muchísimo de la sensibilidad, hay un debate grande de si esta citometría de flujo es demasiado sensible cuando se combina con técnicas de ensayo en fase sólida y el Luminex, o a lo mejor si tú tienes un cross-match por citometría de flujo de linfocitos B positivo, que quizá sea el más difícil de saber si va a ser clínicamente relevante o no, y por ensayo de fase sólida sabes que ese paciente tiene anticuerpos anti-clase II, pues ya la interpretación del cross-match varía. Posiblemente sea un anticuerpo anti-clase II.
Diapositiva número: 33

También se está hablando ahora de lo que es el cross-match, sobre todo en América. Se basa, confiando totalmente en la posibilidad del Luminex para detectar anticuerpos anti-HLA, pues propone no llevar a cabo prueba cruzada final, solamente sería la asignación de ______ entre el tipaje del donante junto con la especificidad detectada por Luminex.
Diapositiva número: 34

Y nuevas aproximaciones que hay al cross-match, que ha evolucionado mucho últimamente, se están utilizando las ventajas de las técnicas en fase sólida para aplicar las técnicas en cross-match. En este caso, lo que se veía sería, digamos, durante la alarma del trasplante, se aislarían las moléculas anti-HLA del donante, las pruebas se fijarían a la bolita y detectaríamos realmente el donante-específico. Es decir, las bolitas ven, digamos, si antígenos no hay ninguno aislas tu la del donante, las fija a las bolitas y en su correspondiente. Entonces ves realmente el tipo de anticuerpo donante-específico, pero anti-HLA.
Y después también se está viendo, ya existe en el mercado, esto lo he probado yo en el laboratorio realmente, es muy robusto y va realmente bien. Lo que pasa es que tampoco no podemos decir, pero sí que es verdad que el cross-match más positivo mientras que el mismo cross-match es totalmente negativo. Y como consistencia, dado que se había identificado previamente los anticuerpos mediante el Luminex y, teóricamente, era el que tenía que ser positivo. Entonces era comúnmente de lo que yo esperaba.
Y por último, también comentaos que el cross-match en endoteliales que, bueno, se están intentando poner a punto, todavía tiene algunos problemillas, y que se realiza sobre precursores de células endoteliales circulantes, mediante citometría de flujo. Entonces podríamos ver antígenos endoteliales que no son HLA.
Diapositiva número: 35

Y bueno, ya por último, haceros saber también que hagáis cuenta de que la interpretación cross-match no es siempre fácil de interpretar. En el taller del inspector de calidad de la Sociedad Española de Inmunología tienen un ejercicio de prueba cruzada donde los sueros son enfrentados a determinadas células. Unas células que el tipaje cuando tú vas a hacer la prueba cruzada lo conocen, ¿no? Es curioso, en muchos sueros hay mucha concordancia, pero es curioso en este suero precisamente, pues no hay concordancia clara. Han dado unos negativos, otros positivos y cuando nos vamos a la caracterización de este suero vemos que tienen una especificidad A3, que tenía las células frente a la cual se enfrentó. Entonces, si tardamos ya un poquito más de tiempo en dar la prueba cruzada, no metamos mucha prisa porque seguramente estos positivos, o estos negativos, no son negativos claros, lógicamente; habrá costado un poco de trabajo. Sin embargo, por la caracterización previa del suero sí. Si nosotros supiéramos que el suero que estamos testeando tiene anticuerpos A23 posiblemente ni siquiera hubiéramos procedido a la prueba cruzada.
Diapositiva número: 36

Como final, pues bueno, debemos apuntar como herramientas que nos aproximen racionalmente al objetivo principal que nos marcamos.
Diapositiva número: 37

Muchas gracias
|



